
【题目】已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。

试回答:
(1)写出下列物质的化学式
X________、 Y________ 、A________ 、B______、 C________。
(2) 反应①的化学方程式为____________________________,
反应②的离子方程式为_______________________________。
【答案】(1) Cl2SO2HCl H2SO4FeCl3
(2) Cl2+SO2+2H2O === 2HCl+H2SO4 2Fe3++SO2+2H2O === 2Fe2++SO+4H+
【解析】
A与硝酸银溶液、稀硝酸反应生成白色沉淀可知A中含有Cl-,B与氯化钡溶液、盐酸生成白色沉淀可知B中含有SO42—;X、Y、H2O生成Cl-和SO42—且X、Y均是有刺激性气味的气体可推知X、Y是二氧化硫和氯气,反应为Cl2+SO2+2H2O=2HCl+H2SO4;X能与铁反应可知X为Cl2,则C为FeCl3、Y为SO2,二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,则A为HCl,B为H2SO4,结合对应物质的性质以及题目要求解答该题。
根据以上分析可知A为HCl,B为H2SO4,C为FeCl3,X为Cl2,Y为SO2,则
(1)由以上分析可知X为Cl2,Y为SO2,A为HCl,B为H2SO4,C为FeCl3;
(2)反应①是氯气氧化二氧化硫,反应的化学方程式Cl2+SO2+2H2O=2HCl+H2SO4;反应②二氧化硫通入氯化铁溶液生成氯化亚铁、硫酸和盐酸,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42—+4H+。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 乙醇的燃烧热为 △H= -a kJ·mol-1,则乙醇燃烧的热化学方程式可表示为:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)H= -a kJ·mol-1
B. 稀硫酸与稀 NaOH 溶液反应的中和热为-57.3 kJ/mol
C. S(g)+O2(g)=SO2(g) △H= -a kJ·mol-1,S(s)+O2(g)=SO2(g) △H= -b kJ·mol-1,则 a>b
D. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) H= -38.6kJ·mol-1
2NH3(g) H= -38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1mol·L-1CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
CH3COO-+H+对于该平衡,下列叙述正确的是 ( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1mol·L-1HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:

(1)电极X的材料是______;电解质溶液Y是________。
(2)银电极为电池的______极,发生的电极反应式为_______________;X电极上发生的电极反应式为_________________。
(3)下图为直流电源电解稀Na2SO4水溶液的装置。通电后在石墨电极a和b附近分别滴加几滴石蕊溶液。则电极a为电解池的_______极,b电极附近出现的现象为______________。
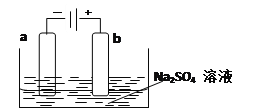
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g) ![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为_____________。
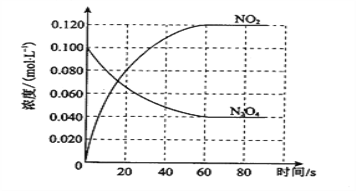
(2)100 ℃时达到平衡后,改变反应温度为T,c(N2O4)以0.0020 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。T______100 ℃(填“大于”或“小于”),判断理由是____________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于烷烃性质的叙述,错误的是
A. 烷烃不能使酸性高锰酸钾溶液褪色
B. 烷烃都能燃烧
C. 烷烃在水中的溶解度随着碳原子数的增加而增大
D. 烷烃都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224 L氯化氢气体溶于635 mL的水(密度为1.00 g/cm3)中,所得盐酸的密度为1.18 g/cm3。求:
(1)该盐酸的溶质质量分数是多少?______________
(2)取这种盐酸10.0 mL,稀释到1.00 L,所得的稀盐酸的物质的量浓度多少?____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com