
【题目】下列说法正确的是
A. 乙醇的燃烧热为 △H= -a kJ·mol-1,则乙醇燃烧的热化学方程式可表示为:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g)H= -a kJ·mol-1
B. 稀硫酸与稀 NaOH 溶液反应的中和热为-57.3 kJ/mol
C. S(g)+O2(g)=SO2(g) △H= -a kJ·mol-1,S(s)+O2(g)=SO2(g) △H= -b kJ·mol-1,则 a>b
D. 500℃、30MPa 下,将 0.5mol N2和 1.5molH2置于密闭的容器中充分反应生成 NH3(g),放热 19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) H= -38.6kJ·mol-1
2NH3(g) H= -38.6kJ·mol-1
【答案】C
【解析】
A、乙醇的燃烧热是指1mol乙醇完全燃烧生成CO2和液态H2O放出的热量,所以醇燃烧的热化学方程式可表示为:C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(l) △H= -a kJ·mol-1,A选项中水的状态不对,故A错;B项中和热都是正值,故B错误;C项S(g)+O2(g)=SO2(g) △H= -a kJ·mol-1,S(s)+O2(g)=SO2(g) △H= -b kJ·mol-1,两个反应中的S状态不同,第一个反应中S为气态,第二个反应中的S为固态,根据盖斯定律知 a>b,故C正确;D、500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,由于合成氨反应是可逆反应,因此1mol完全反应放出的热量大于38.6kJ,D错误;


 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知:(1)Zn(s)+1/2O2(g)=ZnO(s) △H=-348.3kJ·mol-1 ,
(2)2Ag(s)+1/2O2(g)=Ag2O(s) △H=-31.0kJ·mol-1,
则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
A. -317.3kJ·mol-1 B. -379.3kJ·mol-1 C. -332.8kJ·mol-1 D. +317.3kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表物质按碱、酸、盐、碱性氧化物、酸性氧化物的顺序分类正确的是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Na2CO3 | H2SO4 | NaOH | SO2 | CO2 |
B | KOH | HCl | NaCl | CaO | CO |
C | NaOH | H2CO3 | CaCl2 | CuO | SO2 |
D | NaOH | HNO3 | BaCO3 | NO | SO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石油产品A(C4H8),可以合成材料化学重要的物质G和H。己知:
①A和C的核磁共振氢谱都有2组峰,且峰面积之比分别为1∶3和1∶2
②E和F都可发生银镜反应;E的分子式为:C4H4O2
③H2C=CH2+H2O2![]()
![]()
④R-CH2-CHO+HCHO![]()
![]()
G和H的合成路线如下图所示:
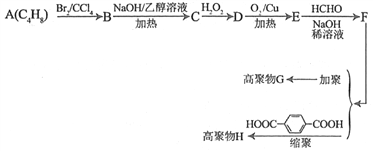
请回答下列问题:
(1)C的名称________________;F中官能团名称为____________________。
(2)A的同分异构体共有___________种(不包括A本身,不含立体异构)
(3)写出B到C的化学方程式和反应类型:
化学方程式为______________________________________________,反应类型是___________。
(4)D→E的化学方程式为___________________________________________。
(5)H的结构简式为_______________________________________________,G的结构简式为____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,ΔH1=-393.5kJ·mol-1,ΔH2=-395.4kJ·mol-1,

下列说法或表示式正确的是
A. 石墨和金刚石的转化是物理变化
B. C(s、石墨)===C(s、金刚石)ΔH =+1.9kJ·mol-1
C. 金刚石的稳定性强于石墨
D. 断裂1mol石墨的化学键吸收的能量比断裂1mol金刚石的化学键吸收的能量少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解足量下列溶液一段时间后,再加入一定量括号内的纯净物,能使溶液恢复到原来的成分和浓度的是
A. AgNO3[AgNO3] B. NaOH[NaOH] C. KCl[H2O] D. CuSO4[CuO]
【答案】D
【解析】石墨电极为惰性电极,溶液中阳离子在阴极放电,阴离子在阳极放电。A、电解AgNO3溶液,Ag+在阴极放电生成Ag,OH-在阳极放电生成O2,且n(Ag)∶n(O2)=2∶1,则应加入Ag2O恢复浓度,故A错误;B、电解NaOH溶液,H+在阴极放电生成H2,OH-在阳极放电生成O2,且n(H2)∶n(O2)=2∶1,则应加入一定量的H2O恢复原样,故B错误;C、电解KCl溶液,H+在阴极放电生成H2,Cl-在阳极放电生成Cl2,且n(H2)∶n(Cl2)=1∶1,则应加入一定量HCl恢复原样,故C错误;D、电解CuSO4溶液,Cu2+在阴极放电生成Cu,OH-在阳极放电生成O2,且n(Cu)∶n(O2)=2∶1,则应加入一定量CuO恢复原样,故D正确。故选D。
点睛:分析电解反应的原理,在两极析出什么物质(固体或气体),相当于什么物质脱离反应体系,根据元素守恒和原子比例,加入对应的物质,即可使溶液完全复原。
【题型】单选题
【结束】
28
【题目】工业上用电解法处理含镍酸性废水并得到单质Ni的原理如图所示。下列说法不正确的是

已知:①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)
A. 碳棒上发生的电极反应:4OH--4e-=O2↑+2H2O
B. 电解过程中,B中NaCl溶液的物质的量浓度将不断减少
C. 为了提高Ni的产率,电解过程中需要控制废水pH
D. 若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生活污水和某些工业废水中的含氮化合物经转化最终会以硝酸盐的形式进入水体,若大量排放会造成水体富营养化。用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。Fe还原水体中NO3-的反应原理如右图所示。
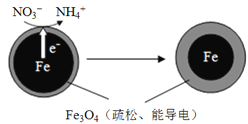
(1)下列说法属于水体污染的危害的有______(填字母)。
a.加剧水资源短缺 b.危害人体健康
(2)NO3-中氮元素的化合价为______。
(3)Fe在反应过程中发生的是______(选填“氧化”或“还原”)反应。
(4)将足量铁粉投入某水体样本中,经一段时间后,测得溶液中离子浓度的有关数据如下(其他离子忽略不计)。
离子 | Na+ | H+ | NO3 | NH4+ | Fe2+ |
浓度/(mol·L1) | 5.0×102 | 5.0×102 | 6.4×101 | y | 2.4×101 |
表中y =______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y为有刺激性气味的气体,有以下转化关系,部分产物未标出。

试回答:
(1)写出下列物质的化学式
X________、 Y________ 、A________ 、B______、 C________。
(2) 反应①的化学方程式为____________________________,
反应②的离子方程式为_______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com