
【题目】以硅孔雀石(主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O,含 SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:
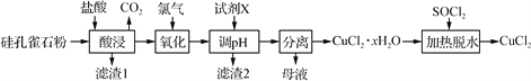
(1)为提高“酸浸”时铜元素的浸出率,可以采取的措施有:
①适当加快搅拌速率;②______________。(任答一点即可)
(2)“氧化”时发生反应的离子方程式为__________。
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______(填化学式);试剂X可选择_____(填字母)。
a. Cu b. NaOH c. Cu(OH)2 d.氨水
(4)“调pH”时,pH不能过高,其原因是_________________________。
【答案】 适当提高盐酸浓度或适当提高反应温度 2Fe2++Cl2=2Fe3++2Cl- Fe(OH)3 c 防止Cu2+转化为Cu(OH) 2沉淀
【解析】试题分析:本题以硅孔雀石为原料制备CuCl2的工艺流程为载体,考查流程的分析,外界条件对化学反应的影响,盐类水解知识应用于物质的分离,离子方程式的书写。
(1)为提高“酸浸”时铜元素的浸取率,可采取的措施有:适当加快搅拌速率,适当提高盐酸的浓度,适当提高反应的温度。
(2)硅孔雀石中加入盐酸“酸浸”时,发生的反应有:CuCO3·Cu(OH)2+4HCl=2CuCl2+CO2↑+3H2O、CuSiO3·2H2O+2HCl=CuCl2+H2SiO3+2H2O、FeCO3+2HCl=FeCl2+H2O+CO2↑、 Fe2O3+6HCl=2FeCl3+3H2O;经过滤得到滤渣1中主要成分为未反应的SiO2和生成的H2SiO3,滤液中主要含CuCl2、FeCl2、FeCl3,用氯气将FeCl2氧化成FeCl3,反应的离子方程式为Cl2+2Fe2+=2Fe3++2Cl-。
(3)根据流程图,加入试剂X调节pH的目的是将Fe3+完全转化为Fe(OH)3沉淀而除去,则“滤渣2”的主要成分为Fe(OH)3。Fe3+在水溶液中存在水解平衡:Fe3++3H2O![]() Fe(OH)3+3H+,能用于调节pH的试剂必须与H+反应且不引入新杂质。a项,Cu与H+不反应,不能调节pH,同时Cu会将FeCl3还原为FeCl2,错误;b项,NaOH能与H+反应,NaOH能调节pH,但引入杂质离子Na+,错误;c项,Cu(OH)2与H+反应生成Cu2+和H2O,c(H+)减小,促进Fe3+水解,能调节pH使Fe3+完全沉淀,且不引入新杂质,正确;d项,氨水能与H+反应,氨水能调节pH,但引入杂质离子NH4+,错误;答案选c。
Fe(OH)3+3H+,能用于调节pH的试剂必须与H+反应且不引入新杂质。a项,Cu与H+不反应,不能调节pH,同时Cu会将FeCl3还原为FeCl2,错误;b项,NaOH能与H+反应,NaOH能调节pH,但引入杂质离子Na+,错误;c项,Cu(OH)2与H+反应生成Cu2+和H2O,c(H+)减小,促进Fe3+水解,能调节pH使Fe3+完全沉淀,且不引入新杂质,正确;d项,氨水能与H+反应,氨水能调节pH,但引入杂质离子NH4+,错误;答案选c。
(4)“调pH”的目的是将Fe3+完全转化为Fe(OH)3沉淀而除去,而Cu2+仍留在溶液中,实现Cu2+和Fe3+的分离。“调pH”时,pH不能过高,防止Cu2+转化为Cu(OH)2沉淀。


科目:高中化学 来源: 题型:
【题目】(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知BaCO3、BaSO4溶度积常数分别为Ksp=5.1×10-9 mol2·L-2,Ksp=1.1×10-10 mol2·L-2,则BaSO4可做钡餐,BaCO3不能作钡餐的主要理由是( )
A. BaSO4的溶度积常数比BaCO3的小
B. SO![]() 没有毒性,CO
没有毒性,CO![]() 有毒性
有毒性
C. BaSO4的密度大
D. 胃酸能与CO![]() 结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
结合,生成CO2和H2O,使BaCO3的溶解平衡向右移动,Ba2+浓度增大,造成人体Ba2+中毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家在研究生物体的化学成分时,发现组成生物体的元素在非生物界都存在,这一事实说明 ( )
A. 生物界和非生物界没有区别 B. 组成生物的物质来源于非生物
C. 生物界和非生物界具有统一性 D. 生物界和非生物界具有差异性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在25 ℃下,向浓度均为0.1 mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为___________。已知25 ℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,![]() =________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
=________。[Ksp(AgBr)=5.4×10-13,Ksp(AgCl)=2.0×10-10]
(3)已知Fe(OH)3的溶度积常数Ksp=1.1×10-36。室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为3时,通过计算说明Fe3+是否沉淀完全_______________________。(提示:当某离子浓度小于10-5 mol·L-1时可以认为该离子沉淀完全)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物等杂质):
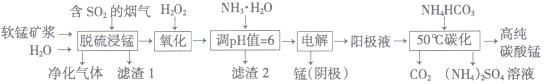
已知:Fe(OH)3的Ksp=l.0×10-38,Al(OH)3的Ksp=1.0×10-34
(1)一定温度下, “脱硫浸锰”主要产物为MnSO4,生成该产物的化学方程式为_________。
(2)常温下,调节pH=6时,得到的“滤渣2”主要成分为Fe(OH)3和_____(化学式),此时溶液中的Fe3+物质的量浓度为_________ 。
(3)“电解”时用惰性电极,阳极的电极反应式为_______________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程武为____________________。“50℃碳化”时加入过量NH4HCO3,可能的原因:①使MnSO4充分转化为MnCO3;②________________;③________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应是一类重要的反应,请按要求完成下列题目。
(1)对反应NH3+O2——NO+H2O(未配平)作分析,并用单线桥法标出电子转移的方向和数目:_____________。该反应中,________是还原剂,________是还原产物,被还原的物质是________。
(2)在一定条件下,反应2NH3+3CuO![]() 3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
3Cu+N2+3H2O能顺利进行,对此反应的分析合理的是________。
①该反应是置换反应
②反应中NH3被氧化为N2
③在反应中体现了金属铜的还原性
④在反应中每生成1 mol H2O转移1 mol电子
(3)在反应2H2S+SO2![]() 3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
3S+2H2O中被氧化的元素与被还原的元素的质量比为 ________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
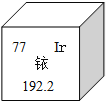
A. 铱的相对原子质量为192.2克
B. 铱原子核内的中子数为77
C. K2IrO3中Ir的化合价为+4
D. 生活中常用的铱金笔为纯净的铱单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com