
【题目】(1)同温同压下,同体积的氨气(NH3)和硫化氢(H2S)气体的质量比为________。
(2)同温同压下,氨气和硫化氢气体的密度比为________。
(3)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(4)在标准状况下,14 g CO与2 g H2的混合气体体积为________L。
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 某温度Ksp(Ag2S)=6![]() 10-50(mol·L-1)3,Ksp(AgCl)=2
10-50(mol·L-1)3,Ksp(AgCl)=2![]() 10-6(mol·L-1)2,则2AgCl(g)+S2-(aq)
10-6(mol·L-1)2,则2AgCl(g)+S2-(aq) ![]() Ag2S(s)+2Cl-(aq)的平衡常数约为6.7
Ag2S(s)+2Cl-(aq)的平衡常数约为6.7![]() 1037mol·L-1
1037mol·L-1
B. pH相同的①CH3COONa ②NaHCO3 ③NaClO三种溶液中c(Na+):③<②<①
C. pH=a的氨水溶液,稀释10倍后,其pH=b,则b<a-1
D. 一定浓度的NaHS溶液在:c(Na+)+c(OH-)=c(H+)+c(HS-)+2c(H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅥA族氢化物的熔沸点比较中,水最高的原因是
A. 水分子间有氢键 B. 水分子内的共价健最稳定
C. 水分子间的范德华力最大 D. 氧元素的非金属性最强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以煤为原料可合成一系列燃料。
(1)已知:①2H2(g)+O2(g)= 2H2O(g)△H=-483.6kJ/mol
②CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H=+49.0kJ/mol
请写出甲醇燃烧生成H2O(g)的热化学方程式_________;
(2)向1L密闭容器中加入2mol CO、4mol H2,在适当的催化剂作用下,发生反应:2CO(g)+4H2(g)![]() CH3OCH3(l)+H2O(l)△H=+71kJ/mol
CH3OCH3(l)+H2O(l)△H=+71kJ/mol
①该反应能否_________自发进行(填“能”、“不能”或“无法判断”)
②下列叙述能说明此反应达到平衡状态的是_________.
a.混合气体的平均相对分子质量保持不变
b.CO和H2的转化率相等
c.CO和H2的体积分数保持不变
d.混合气体的密度保持不变
e.1mol CO生成的同时有1mol O-H键断裂
(3)CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
CH3OH(g)+H2O(g)△H<0在一定条件下,某反应过程中部分数据如下表:
反应条件 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
恒温 恒容 (T1℃、 2L) | 0min | 2 | 6 | 0 | 0 |
10min | 4.5 | ||||
20min | 1 | ||||
30min | 1 |
①0~10min内,用H2O(g)表示的化学反应速率v(H20)=_________mol/(L·min)
②达到平衡时,该反应的平衡常数K=_________(用分数表示),平衡时H2的转化率是_________。
③在其它条件不变的情况下,若30min时改变温度为T
(4)用甲醚(CH3OCH3)作为燃料电池的原料,请写出在碱性介质中电池负极反应式_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO的一种制备流程图如下:

已知:Ksp[Zn(OH)2]= 1.2×10—17;Zn(OH)2既能溶于强酸,又能溶于强碱.还能溶于氨水,生成[Zn(NH3)4]2+.
(1)溶液A中加稀H2SO4生成Zn(OH)2的离子方程式为_________。
(2)常温下,Zn(OH)2饱和溶液中c(Zn2+)=3×10—6mol/L,若溶液A中加入稀H2SO4过量,会溶解产生的Zn(OH)2,Zn(OH)2开始溶解的pH为_________,为防止Zn(OH)2溶解,可将稀H2SO4改为_________。(lg2=0.3)
(3)“部分氧化”阶段,NaClO3被还原为Cl—,还原剂与氧化剂反应的物质的量之比是_________。
(4)①由溶液B制得Fe3O4胶体粒子的过程中通入N2的原因是_________。
②Fe3O4胶体粒子的直径的范围是_________。
③确定滤液B中含有Fe2+的试剂是_________。
(5)试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计了测定气体摩尔体积的探究实验,利用氯酸钾分解制O2。

实验步骤如下:
①连接好实验装置,检查装置的气密性。
②把适量的氯酸钾粉末和少量二氧化锰粉末混合均匀,放入干燥的试管中,准确称量试管和药品的总质量为15.95 g。
③加热,开始反应,直到不再有气体产生为止。
④测量排入量筒中水的体积为285.0 mL,换算成标准状况下氧气的体积为279. 7 mL。
⑤准确称量试管和残留物的质量为15. 55 g。
根据上述实验过程,回答下列问题:
(1)如何检查装置的气密性?____________________________________________。
(2)以下是测量收集的气体体积必须包括的几个步骤:
①调整量筒的高度使广口瓶和量筒内的液面高度相同;
②使试管和广口瓶内气体都冷却至室温;
③读取量筒内液体的体积。
这三步操作的正确顺序是_________________(请填写步骤代号)。
进行③的实验操作时,若仰视读数,则读取氧气的体积_______(填“偏大”“偏小”或“无影响”)。
(3)实验过程中产生氧气的物质的量是_____mol;实验测得氧气的气体摩尔体积是______(保留小数点后两位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯苯在染料、医药工业中有广泛的应用,某实验小组利用如下装置合成氯苯(支撑用的铁架台部分省略)并通过一定操作提纯氯苯。
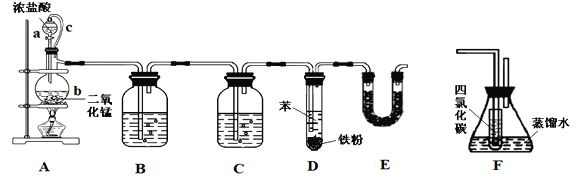
反应物和产物的相关数据列表如下:
密度/g·cm-3 | 沸点/℃ | 水中溶解性 | |
苯 | 0.879 | 80.1 | 微溶 |
氯苯 | 1.11 | 131.7 | 不溶 |
请按要求回答下列问题。
(1)装置A中橡胶管c的作用是______________,装置E的作用是__________________。
(2)实验时;使a中的浓盐酸缓缓滴下,可观察到仪器b内的现象是________________,写出反应的离子方程式______________________________________。
(3)为证明氯气和苯发生的是取代而不是加成反应,该小组用装置F说明,则装置F置于________之间(填字母),F中小试管内CCl4的作用是___________________,还需使用的试剂是______________。
(4)已知D中加入5 mL苯,经过提纯后收集到氯苯3.0 g,则氯苯的产率为_________%(保留三位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如右下图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. 含T的盐溶液一定显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氢气与溴蒸汽化合生成1mol溴化氢时放出的能量51kJ,1mol H-H、Br-Br和H-Br键断裂时需要吸收的能量分别是436kJ、a kJ和369kJ则a为( )
A. 404B. 260C. 230D. 200
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com