
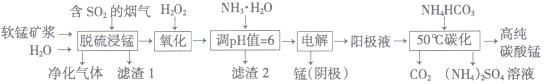
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物等杂质):
已知:Fe(OH)3的Ksp=l.0×10-38,Al(OH)3的Ksp=1.0×10-34
(1)一定温度下, “脱硫浸锰”主要产物为MnSO4,生成该产物的化学方程式为_________。
(2)常温下,调节pH=6时,得到的“滤渣2”主要成分为Fe(OH)3和_____(化学式),此时溶液中的Fe3+物质的量浓度为_________ 。
(3)“电解”时用惰性电极,阳极的电极反应式为_______________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程武为____________________。“50℃碳化”时加入过量NH4HCO3,可能的原因:①使MnSO4充分转化为MnCO3;②________________;③________________。
【答案】 MnO2+SO2=MnSO4(2分)或H2O+SO2 =H2SO3、MnO2+H2SO3=MnSO4+H2O Al (OH)3 l.0×l0-14mol/L 4OH--4e-=O2↑+2H2O Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O NH4HCO3与电解生成的酸反应,防止MnCO3沉淀溶解损失 NH4HCO3受热分解损失
MnCO3↓+CO2↑+H2O NH4HCO3与电解生成的酸反应,防止MnCO3沉淀溶解损失 NH4HCO3受热分解损失
【解析】(1)由流程可知,“脱硫浸锰”环节主要是二氧化硫与MnO2作用生成硫酸锰,化学方程式为MnO2+SO2=MnSO4或H2O+SO2=H2SO3、MnO2+H2SO3=MnSO4+H2O。
(2)“脱硫浸锰”环节,铁、铝的氧化物等杂质也会反应,溶液中会有Al3+、Fe3+,可能还有Fe2+;氧化环节,加双氧水确保溶液中铁元素以Fe3+形式存在;加氨水调节溶液的PH=5~6把Al3+和Fe3+转化为沉淀除去,故“滤渣2”中主要成分的化学式为Fe(OH)3、Al(OH)3;常温下,pH=6时c(H+)=10-6mol/L,c(OH-)=Kw/c(H+)=10-8mol/L,此时溶液中的Fe3+物质的量浓度为: 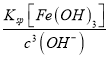 =
=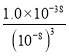 molL-1=l.0×l0-14mol/L。
molL-1=l.0×l0-14mol/L。
(3)“电解”时用惰性电极,阳极由水电离出的氢氧根离子放电,发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O(或2H2O-4e-=O2↑+4H+)。
(4)“50℃碳化”得到高纯碳酸锰,结合流程可得,Mn2+和HCO3-反应生成MnCO3和CO2,根据原子守恒,还有水生成,故离子方程式为Mn2++2HCO3-![]() MnCO3↓+CO2↑+H2O;因为①原溶液显酸性、②碳酸氢铵受热易分解,所以“50℃碳化”时加入过量NH4HCO3,可能的原因是:①NH4HCO3与H+反应,防止MnCO3沉淀溶解损失;②可以防止NH4HCO3受热分解损失。
MnCO3↓+CO2↑+H2O;因为①原溶液显酸性、②碳酸氢铵受热易分解,所以“50℃碳化”时加入过量NH4HCO3,可能的原因是:①NH4HCO3与H+反应,防止MnCO3沉淀溶解损失;②可以防止NH4HCO3受热分解损失。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质间的反应不能通过一步反应实现的是( )
A.Na2CO3→NaClB.NaCl→ NaOH
C.NaOH→NaClD.CuO→Cu(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硅孔雀石(主要成分为 CuCO3·Cu(OH)2、CuSiO3·2H2O,含 SiO2、FeCO3、 Fe2O3等杂质)为原料制备CuCl2的工艺流程如下:
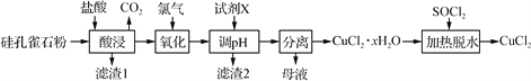
(1)为提高“酸浸”时铜元素的浸出率,可以采取的措施有:
①适当加快搅拌速率;②______________。(任答一点即可)
(2)“氧化”时发生反应的离子方程式为__________。
(3)“滤渣1”的主要成分为SiO2和H2SiO3等,“滤渣2”的主要成分为______(填化学式);试剂X可选择_____(填字母)。
a. Cu b. NaOH c. Cu(OH)2 d.氨水
(4)“调pH”时,pH不能过高,其原因是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以Pt为电极,电解含有0.10molM+和0.10molN3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如右图。对离子氧化能力的强弱判断正确的是( )
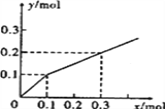
A. N3+>H+>M+
B. M+>N3+>H+
C. M+>H+>N3+
D. 条件不足,无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列反应的化学方程式,用双线桥法标明电子转移的方向和数目,并注明“被氧化”、“被还原”。
①Fe2O3与CO在高温下的反应:___________________________________。
②KClO3与MnO2在共热条件下反应:________________________________。
③H2S气体和SO2气体反应生成S和水:______________________________。
(2)写出下列反应的离子方程式,并用单线桥法标明电子转移的方向和数目。
①Cu和AgNO3溶液反应:________________________________________。
②实验室制Cl2的反应为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O:___________________________。
MnCl2+Cl2↑+2H2O:___________________________。
③向FeCl2溶液中通入Cl2生成FeCl3:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
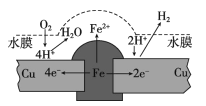
A. 腐蚀过程中铜极上始终只发生: 2H++2e-= H2↑
B. 若水膜中溶有食盐将加快铁铆钉的腐蚀
C. 若在金属表面涂一层油脂能防止铁铆钉被腐蚀
D. 若将该铜板与直流负极相连,则铁铜均难被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)维生素C又称为抗坏血酸,在人体内有重要的功能。例如,帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+。这说明维生素C具有________(填“氧化性”或“还原性”)。
(2)2Na+O2![]() Na2O2反应中,
Na2O2反应中,
①________被氧化,________是氧化剂,氧化产物是_______,过氧化钠中氧元素的化合价是_______。
②此反应中若转移了2 mol的电子,则需要氧气________ mol。
③用单线桥或双线桥法表示反应中电子转移的方向和数目:______________________。
(3)根据反应①2FeCl3+2KI=2FeCl2+2KCl+I2,②2FeCl2+Cl2=2FeCl3,判断下列物质的氧化性由强到弱的顺序中,正确的是____________。
A.Fe3+>Cl2>I2 B.Cl2>I2>Fe3+
C.I2>Cl2>Fe3+ D.Cl2>Fe3+>I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H22NH3 | |||
起始浓度mol/L | 1.0 | 3.0 | 0 |
2秒末浓度mol/L | 0.6 | 1.8 | a |
A. 0.2mol/(Ls) B. 0.4mol/(Ls) C. 0.6mol/(Ls) D. 0.8mol/(Ls)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com