
【题目】已知合成氨反应的浓度数据如下,当用氨气浓度的增加来表示该化学反应速率时,其速率为( )
N2+3H22NH3 | |||
起始浓度mol/L | 1.0 | 3.0 | 0 |
2秒末浓度mol/L | 0.6 | 1.8 | a |
A. 0.2mol/(Ls) B. 0.4mol/(Ls) C. 0.6mol/(Ls) D. 0.8mol/(Ls)
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物等杂质):
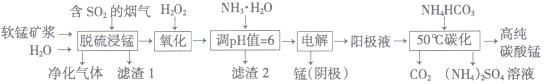
已知:Fe(OH)3的Ksp=l.0×10-38,Al(OH)3的Ksp=1.0×10-34
(1)一定温度下, “脱硫浸锰”主要产物为MnSO4,生成该产物的化学方程式为_________。
(2)常温下,调节pH=6时,得到的“滤渣2”主要成分为Fe(OH)3和_____(化学式),此时溶液中的Fe3+物质的量浓度为_________ 。
(3)“电解”时用惰性电极,阳极的电极反应式为_______________。
(4)“50℃碳化”得到高纯碳酸锰,反应的离子方程武为____________________。“50℃碳化”时加入过量NH4HCO3,可能的原因:①使MnSO4充分转化为MnCO3;②________________;③________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+)
B. 两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=l0c2
C. pH =11的NaOH溶液与pH=3的醋酸溶液等体积混合,滴入石蕊溶液呈红色
D. NaHCO3溶液中有:HCO3-+H2O![]() CO32-+H3O+加水稀释后,H+浓度减小
CO32-+H3O+加水稀释后,H+浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2014年5月7日,天津某工程检测公司在进行探伤作业期间,一枚黄豆粒大小的放射源铱-192丢失,造成了严重的安全事故,图示是铱在元素周期表中的信息,下列说法正确的是( )
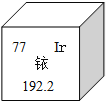
A. 铱的相对原子质量为192.2克
B. 铱原子核内的中子数为77
C. K2IrO3中Ir的化合价为+4
D. 生活中常用的铱金笔为纯净的铱单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲,乙两个容器中,分别加入0.1mol/L的NaCl溶液与0.1mol/L的AgNO3溶液后,以Pt为电极进行电解时,下列说法中正确的是( )
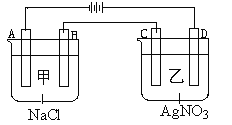
A. 电解后两烧杯中溶液的pH均增大
B. 在A、B、C、D各电极上生成物的物质的量之比为:2:2:4:1
C. 电解过程中,A电极上发生还原反应,2Cl--2e-=Cl2
D. 电解后向溶液中加入适量AgNO3固体,可使溶液恢复到原来的浓度和pH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能在溶液中大量共存的一组离子是( )
A.Cu2+、SO42-、OH—、K+B.Na+、CO32-、H+、Cl-
C.H+、Cl-、NO3-、Ba2+D.Ca2+、H+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质的方法正确的是(括号内的是杂质)( )
A.N2(CO):通过灼热的CuO粉末
B.SO2 (HCl):通入饱和碳酸氢钠溶液中
C.NaCl(NH4Cl):加热
D.NO2(NO):通入水中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义。
(1)用CO可以合成甲醇。已知:
CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.5 kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
H2(g)+![]() O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
则CO(g)+2H2(g) ![]() CH3OH(g) ΔH=________kJ·mol-1
CH3OH(g) ΔH=________kJ·mol-1
(2)下列措施中能够增大上述合成甲醇反应的反应速率的是________(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
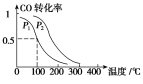
(3)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如右图所示。
①p1________p2(填“大于”、“小于”或“等于”);
②100 ℃时,该反应的化学平衡常数K=________(mol·L-1)-2;
③在其它条件不变的情况下,再增加a mol CO和2a molH2,达到新平衡时,CO的转化率________(填“增大”、“减小”或“不变”)。
(4)某科研小组用SO2为原料制取硫酸。
①利用原电池原理,用SO2、O2和H2O来制备硫酸,该电池用多孔材料作电极,它能吸附气体,同时也能使气体与电解质溶液充分接触。请写出该电池的负极的电极反应式________________。
②用Na2SO3溶液充分吸收SO2得NaHSO3溶液,然后电解该溶液可制得硫酸。电解原理示意图如下图所示。请写出开始时阳极反应的电极反应式________________。
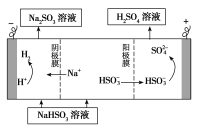
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石的主要成分是Cu2(OH)2CO3,受热分解生成三种氧化物,并有如图所示的转化关系:
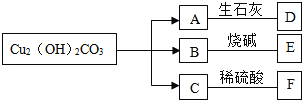
回答问题:
(1)D在农业生产中的用途是__________________;
(2)写出碱式碳酸铜受热分解的化学方程式:____________________;
(3)D和E反应的化学方程式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com