
����Ŀ����ͼ��ʾ���ף������������У��ֱ����0.1mol/L��NaCl��Һ��0.1mol/L��AgNO3��Һ����PtΪ�缫���е��ʱ������˵������ȷ���ǣ� ��
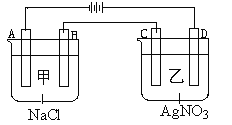
A. �������ձ�����Һ��pH������
B. ��A��B��C��D���缫������������ʵ���֮��Ϊ��2:2:4:1
C. �������У�A�缫�Ϸ�����ԭ��Ӧ��2Cl--2e-=Cl2
D. ��������Һ�м�������AgNO3���壬��ʹ��Һ�ָ���ԭ����Ũ�Ⱥ�pH
���𰸡�B
��������A. ����Ȼ�����Һ�����������ƣ�������Һ��pH�������������Һ�������ᣬ������Һ��pH��С����A����B.����ͼʾ���õ�A���������õ缫���������ӵõ��ӣ�2H++2e-=H2����B���������õ缫����������ʧ���ӣ��缫��ӦΪ2Cl--2e-=Cl2����C���������õ缫����������������Ag++e-=Ag��D���������õ缫�ϲ���������4OH--4e-=O2��+2H2O�������缫��ת�Ƶ��ӵ����ʵ�������ȵģ���ת�Ƶ���1mol��������A��B��C��D���缫�����ɵ����ʵ���֮��Ϊ0.5��0.5��1��0.25=2��2��4��1����B��ȷ��C. A���������õ缫���������ӵõ��ӣ�2H++2e-=H2������C����D. ���AgNO3��Һ���ܷ�ӦΪ4AgNO3 + 2H2O ![]() 4Ag��+ O2��+ 4HNO3��Ҫʹ��Һ�ָ���ԭ����Ũ�Ⱥ�pH����������������ﲻ��Ҫ��Ӧ�ü������������壬��D����ѡB��
4Ag��+ O2��+ 4HNO3��Ҫʹ��Һ�ָ���ԭ����Ũ�Ⱥ�pH����������������ﲻ��Ҫ��Ӧ�ü������������壬��D����ѡB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����PtΪ�缫����⺬��0.10molM+��0.10molN3+(M+��N3+��Ϊ����������)����Һ�����������������ʻ�����������ʵ���(y)�뵼����ͨ�����ӵ����ʵ���(x)�Ĺ�ϵ����ͼ������������������ǿ���ж���ȷ���ǣ� ��
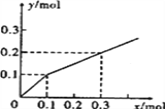
A. N3+>H+>M+
B. M+>N3+>H+
C. M+>H+>N3+
D. �������㣬��ȷ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾװ���У��ס��ҡ��������ձ����ηֱ�ʢ��100 g 5.00%��NaOH��Һ��������CuSO4��Һ��100 g 10.00%��K2SO4��Һ���缫��Ϊʯī�缫��
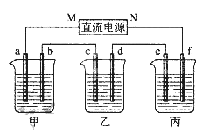
��ͨ��Դ������һ��ʱ���ñ���K2SO4Ũ��Ϊ10.47%������c�缫�������ӡ��ݴ˻ش����⣺
��1����Դ��N��Ϊ________����
��2���缫b�Ϸ����ĵ缫��ӦΪ:__________________�����ɵ������ڱ�״���µ����Ϊ__________L��������λ��Ч���֣�;
��3����Ҫʹ����Һ�ָ������ǰ��״̬����������Һ�м���________���ѧʽ��������Ϊ________g��������λ��Ч���֣���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶Ⱥ�ѹǿ�£���װ��N2��NO2���������Թܵ�����ˮ�У����㹻��ʱ����Թ�������������СΪԭ�����3/5����ԭ���������N2��NO2�������
A. 2/3 B. 3/2 C. 3/5 D. 5/3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I�������ա�������ԭ���������������еij���������ơ��ƿ��ơ�Ƶ��벣�����������������������ĭ��_______________________________________________________________
II��һ�ܷ���ϵ�з������з�Ӧ��N2 +3H2 ![]() 2NH3 +Q����ͼ��ijһʱ����з�Ӧ�����뷴Ӧ���̵����߹�ϵͼ��
2NH3 +Q����ͼ��ijһʱ����з�Ӧ�����뷴Ӧ���̵����߹�ϵͼ��

�ش��������⣺
��1������ƽ��״̬��ʱ�����_______________________
��2��t1��t3��t4ʱ����ϵ�зֱ���ʲô���������˱仯��____________�� ____________��____________
��3�����и�ʱ���ʱ�����İٷֺ�����ߵ�����______��
A��t0��t1 B��t2��t3 C��t3��t4 D��t5��t6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�ϳɰ���Ӧ��Ũ���������£����ð���Ũ�ȵ���������ʾ�û�ѧ��Ӧ����ʱ��������Ϊ�� ��
N2+3H22NH3 | |||
��ʼŨ��mol/L | 1.0 | 3.0 | 0 |
2��ĩŨ��mol/L | 0.6 | 1.8 | a |
A. 0.2mol/��Ls�� B. 0.4mol/��Ls�� C. 0.6mol/��Ls�� D. 0.8mol/��Ls��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����pH=1����ɫ����Һ�в��ܴ���������������ǣ� ��
A.Al3+��Ag+��NO3����Cl��
B.Mg2+��NH4+��NO3����Cl��
C.Ba2+��K+��S2����Cl��
D.Zn2+��Na+��NO3����SO42��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵������ȷ����
A.1 mol�����������NA��������ӵ��������
B.NA���������Ӻ�NA���������ӵ������ȵ���16��1
C.30 g����(C2H6)������ԭ����ĿΪNA
D.�ڱ�״���£� 0.5NA������������ռ���Լ��11.2 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500��ʱ����0.3mol SO2��0.2mol O2����һ�����Ϊ10L��ʢ��V2O5(����)������ܱ������У������¶Ȳ��䣬��2min�������ڵ�ѹǿ���ٱ仯����ʱ������ѹǿ��С20%������˵����ȷ������ ��
A�����¶��´˷�Ӧ��ƽ�ⳣ��K=400
B�������������䣬�ٳ���0.3mol SO2��0.2mol O2ƽ��ʱ��SO2�������������
C��ƽ��ʱ��SO2��ת����Ϊ95��
D��ǰ2min SO2��ƽ����Ӧ����0.02mol/(L��s)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com