
【题目】NA表示阿伏加德罗常数的值,下列叙述正确的是
A.1molCl2发生反应时,转移的电子数一定为2NA
B.1.7g H2O2中含有的电子数为0.9 NA
C.1mol Na2O2 固体中含离子总数为4 NA
D.标准状况下,2.24L苯所含分子数为0.1NA
科目:高中化学 来源: 题型:
【题目】NaClO、NaNO3、Na2SO3等钠盐在多领域有着较广的应用。
(1)上述三种盐所涉及的五种元素中,半径较小的原子是______________;原子核外最外层p亚层上电子自旋状态只有一种的元素是_____________。
(2)碱性条件下,铝粉可除去工业废水中的NaNO2,处理过程中产生一种能使湿润红色石蕊试纸变蓝的气体。产物中铝元素的存在形式_____________(填化学符号);每摩尔铝粉可处理_____________gNaNO2。
(3)新冠疫情发生后,有人用电解食盐水自制NaClO消毒液,装置如图(电极都是石墨)。电极a应接在直流电源的_____________极;该装置中发生的化学方程式为_____________
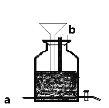
(4)Na2SO3溶液中存在水解平衡![]() +H2O
+H2O![]()
![]() +
+![]() 设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
设计简单实验证明该平衡存在__________________。0.1mol/L Na2SO3溶液先升温再降温,过程中(溶液体积变化不计)PH如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
PH | 9.66 | 9.52 | 9.37 | 9.25 |
升温过程中PH减小的原因是_____________;①与④相比;C(![]() )①____________④(填“>”或“<”).
)①____________④(填“>”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用下图所示装置制备乙酸乙酯。实验如下:
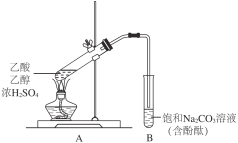
Ⅰ.向2 mL浓H2SO4和2 mL乙醇混合液中滴入2 mL乙酸后,加热试管A;
Ⅱ.一段时间后,试管B中红色溶液上方出现油状液体;
Ⅲ.停止加热,振荡试管B,油状液体层变薄,下层红色溶液褪色。
(1)为了加快酯化反应速率,该同学采取的措施有_____________。
(2)欲提高乙酸的转化率,还可采取的措施有_______________。
(3)试管B中溶液显红色的原因是___________(用离子方程式表示)。
(4)Ⅱ中油状液体的成分是__________。
(5)Ⅲ中红色褪去的原因,可能是酚酞溶于乙酸乙酯中。证明该推测的实验方案是_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表给出了六种元素的相关信息,其中A、B、C、D、E、F为短周期元素,原子序数依次递增。
元素 | 相关信息 |
A | 单质为密度最小的气体 |
B | 元素最高正价与最低负价之和为0 |
D | 可形成D2、D3两种气态单质,其中一单质是保护地球地表环境的重要屏障 |
E | 存在质量数为23,中子数为12的核素 |
F | 单质F为淡黄色固体 |
根据上述信息填空:
(1)元素D在元素周期表中的位置是____________。E基态原子的电子排布式_______________________。
(2)化合物甲是一种强氧化剂,由元素D和E组成,写出一种甲的用途:_______________,
书写化合物甲与BD2的反应式并标出电子转移情况:_______________。
(3)化合物乙由元素D和F组成,气体乙与A2F反应的化学方程式是______________。化合物乙的危害_______________________。(写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. SiF4和SO32-的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:电流效率=电路中通过的电子数与消耗负极失去电子总数之比。现有两个电池Ⅰ、Ⅱ,装置如图所示。
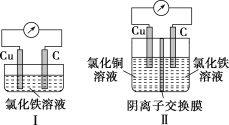
下列说法正确的是( )
A.Ⅰ和Ⅱ的电池反应不同B.Ⅰ和Ⅱ的能量转化形式不同
C.Ⅰ的电流效率低于Ⅱ的电流效率D.放电一段时间后,Ⅰ、Ⅱ中都只含1种溶质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com