
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
【答案】 浓盐酸 饱和食盐水 稀硝酸 水 e→f(或f→e)→c→b→d 通过观察气泡调节气体的流速 防止水蒸气进入装置Ⅸ中 NOCl+2NaOH=NaCl+NaNO2+H2O HNO3(浓)+3HCl(浓)=NOCl↑+Cl2↑+2H2O
【解析】(1)实验室加热制取氯气是用MnO2与浓盐酸加热生成的,所以分液漏斗中装的是浓盐酸,装置Ⅱ是用于吸收氯气中HCl气体,所以内装饱和的食盐水;实验室里NO是用Cu和稀硝酸反应制取的,所以分液漏斗中装的是稀硝酸,装置Ⅱ是用于吸收NO中HNO3蒸气的,因此内装水即可。
(2)已知NOCl沸点为-5.5 ℃,遇水易水解,所以可用冰盐冷却收集液体NOCl,再用装有无水CaCl2的干燥管Ⅶ防止水蒸气进入装置Ⅸ中使NOCl变质,由于NO和Cl2都有毒且污染环境,所以用NaOH吸收尾气,因此①接口顺序为a→e→f(或f→e) →c→b→d,②通过观察洗气瓶中的气泡的快慢,调节NO、Cl2气体的流速,以达到最佳反应比,提高原料的利用率,减少有害气体的排放,③装置Ⅶ中装有的无水CaCl2,是防止水蒸气进入装置Ⅸ中使生成的NOCl变质,④NOCl遇水反应生成HCl和HNO2,再与NaOH反应,所以反应的化学方程式为:NOCl+2NaOH![]() NaCl+NaNO2+H2O。
NaCl+NaNO2+H2O。
(3)由题中叙述可知,反应物为浓硝酸和浓盐酸,生成物为亚硝酰氯和氯气,所以可写出反应的化学方程式为HNO3(浓)+3HCl(浓)![]() NOCl↑+Cl2↑+2H2O。
NOCl↑+Cl2↑+2H2O。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 常温下,78 g Na2O2中含有的阴离子数是2NA
B. 标况下,22.4 L CCl4含有的共价键数是4NA
C. 2.4g镁在足量氧气中燃烧,转移的电子数是0.1NA
D. 铁铝混合物与一定量稀盐酸反应生成1 mol H2时,转移电子数是2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列有关问题:
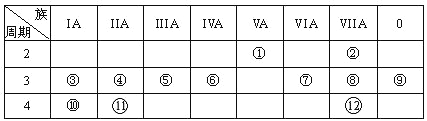
(1)画出原子的结构示意图:④______________
(2)在①~12元素中,金属性最强的元素是______,非金属性最强的元素是____,最不活泼的元素是_____。(均填元素符号)
(3)元素⑦与元素⑧相比,非金属性较强的是______(用元素符号表示),下列表述中能证明这一事实的是________。
a.常温下⑦的单质和⑧的单质状态不同
b.⑧的氢化物比⑦的氢化物稳定
c.一定条件下⑦和⑧的单质都能与氢氧化钠溶液反应
(4)元素⑤的最高价氧化物的水化物分别与元素③⑧的最高价氧化物的水化物反应的离子方程式_________, _________
(5)第三周期中原子半径最大的元素跟它同周期原子半径最小的元素它们可以形成化合物,用电子式表示其形成过程:__________。
(6)已知某元素原子最外层电子数是其次外层电子数的2倍,该元素可以与⑧形成一种AB4型的化合物,请用电子式表示其形成过程:______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质性质的叙述一定不正确的是
A. 向FeCl2溶液中滴加NH4SCN溶液,溶液显红色
B. KAl(SO4) 2·12H2O溶于水可形成 Al(OH)3胶体
C. NH4Cl与Ca(OH)2混合加热可生成NH3
D. Cu与FeCl3溶液反应可生成CuCl2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟基扁桃酸可由苯酚和乙醛酸通过一步反应制得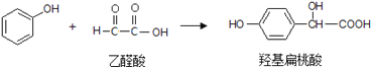
下列有关说法正确的是( )
A. 上述反应属于取代反应
B. 羟基扁桃酸分子中处于同一平面的原子最多有8个
C. 乙醛酸的核磁共振氢谱中有2个吸收峰
D. 羟基扁桃酸能与FeCl3溶液发生显色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 NA 表示阿伏加德罗常数的值,下列说法中正确的是
A. 1molCH4 与 Cl2 在光照条件下反应生成的 CH3Cl 分子数为 NA
B. 5.6g Fe 和 6.4g Cu 分别与足量 Cl2 反应,转移的电子数均为 0.2NA
C. 0.1mol/L 的 FeCl3 溶液中,Fe3+的数目为 0.1 NA
D. 3.0 g 葡萄糖和醋酸的混合物中含有的原子总数为 0.4 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
主族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)写出元素符号和名称:
①________,②________,⑧________,⑨________。
(2)写出下列反应的化学方程式:
⑤的氧化物跟④的氢氧化物溶液反应:________________________________
⑥的单质在③的单质中燃烧:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含卤族元素的化合物在科研和生产中有许多重要用途。如:2molSb(CH3)3、2molSb(CH3)2Br和2molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物: [Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知Sb与N同主族。请回答:
(1)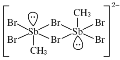 中,H、C、Br的电负性由小到大的顺序为________,溴原子的价电子排布式为_____________________。
中,H、C、Br的电负性由小到大的顺序为________,溴原子的价电子排布式为_____________________。
(2)[Sb2(CH3)5]+的结构式为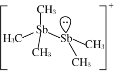 ,Sb原子的杂化轨道类型为_________。写出一种与CH3-互为等电子体的分子______________。
,Sb原子的杂化轨道类型为_________。写出一种与CH3-互为等电子体的分子______________。
(3)X射线衍射测定等发现,I3ASF6中存在I3+离子。I3+离子的几何构型为___________。
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a) [GaCl2+][SbCl4—]或(b) [SbCl2+][GaCl4—],该离子化合物最可能的结构组成为______(填“a”或“b”),理由是______________________。
(5)固态PCl5结构中存在PCl4+和PCl6-两种离子,其晶胞如图所示。
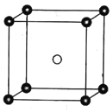
已知晶胞的边长为a pm,阿伏加德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com