
【题目】含卤族元素的化合物在科研和生产中有许多重要用途。如:2molSb(CH3)3、2molSb(CH3)2Br和2molSb(CH3)Br2进行重组反应可生成空间位阻最小的离子化合物: [Sb2(CH3)5]2 [Sb2(CH3)2Br6],已知Sb与N同主族。请回答:
(1)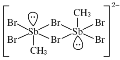 中,H、C、Br的电负性由小到大的顺序为________,溴原子的价电子排布式为_____________________。
中,H、C、Br的电负性由小到大的顺序为________,溴原子的价电子排布式为_____________________。
(2)[Sb2(CH3)5]+的结构式为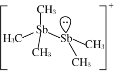 ,Sb原子的杂化轨道类型为_________。写出一种与CH3-互为等电子体的分子______________。
,Sb原子的杂化轨道类型为_________。写出一种与CH3-互为等电子体的分子______________。
(3)X射线衍射测定等发现,I3ASF6中存在I3+离子。I3+离子的几何构型为___________。
(4)一定条件下SbCl3与GaCl3以物质的量之比为l:l混合得到一种固态离子化合物,其结构组成可能为:(a) [GaCl2+][SbCl4—]或(b) [SbCl2+][GaCl4—],该离子化合物最可能的结构组成为______(填“a”或“b”),理由是______________________。
(5)固态PCl5结构中存在PCl4+和PCl6-两种离子,其晶胞如图所示。
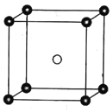
已知晶胞的边长为a pm,阿伏加德罗常数值用NA表示。则PCl4+和PCl6-之间的最短距离为_______pm,固态PCl5的密度为______gcm-3。
【答案】H<C<Br4s24p5sp3杂化NH3V形bGaCl3分子中,Ga原子周围价层电子对数为3,是电子对的接受体,更容易与Cl—上的孤电子对结合,形成配位键,构成[GaCl4—]离子,因此可能结构应是[SbCl2+][GaCl4—]![]()
![]()
![]()
【解析】
(1).非金属性越强电负性越大;溴是35号元素,溴原子4个电子层,最外层有7个电子;(2)根据结构式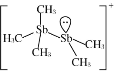 ,Sb原子形成3个单键,有1对孤对电子;含有相同的原子数和价电子数的微粒为等电子体。(3)I3+中心I原子外层有6个电子,其中两个分别和两端I原子生成共价键,剩余4个电子是两对孤对电子,于是中心I原子有4对价电子对,其中两对成键电子对,两对孤对电子对.四对电子对是sp3杂化。(4)[SbCl2+][GaCl4—]中阳离子Sb为+3价,符合N族元素的价键规律,阴离子Ga核外3个电子与3个Cl原子形成共用电子对后,含有1个空的P轨道,可以结合1个氯离子形成8电子稳定结构;(5)PCl4+和PCl6-之间的最短距离为晶胞中心到顶点的距离;根据
,Sb原子形成3个单键,有1对孤对电子;含有相同的原子数和价电子数的微粒为等电子体。(3)I3+中心I原子外层有6个电子,其中两个分别和两端I原子生成共价键,剩余4个电子是两对孤对电子,于是中心I原子有4对价电子对,其中两对成键电子对,两对孤对电子对.四对电子对是sp3杂化。(4)[SbCl2+][GaCl4—]中阳离子Sb为+3价,符合N族元素的价键规律,阴离子Ga核外3个电子与3个Cl原子形成共用电子对后,含有1个空的P轨道,可以结合1个氯离子形成8电子稳定结构;(5)PCl4+和PCl6-之间的最短距离为晶胞中心到顶点的距离;根据![]() 计算晶胞密度。
计算晶胞密度。
(1).非金属性越强电负性越大,所以H、C、Br的电负性由小到大的顺序为H<C<Br;溴是35号元素,溴原子有4个电子层,最外层有7个电子,价电子排布是4s24p5;(2)根据结构式 ,两个Sb原子中一个形成四个单键,另一个形成3个单键且有1对孤对电子,所以两个Sb原子的杂化轨道类型皆为sp3;NH3和CH3-含有相同的原子数和价电子数,所以与CH3-互为等电子体的分子是NH3。(3)I3+中心I原子外层有6个电子,其中两个分别和两端I原子生成共价键,剩余4个电子是两对孤对电子,于是中心I原子有4对价电子对,其中两对成键电子对,两对孤对电子对.四对电子对是sp3杂化,空间构型是V型;(4)[SbCl2+][GaCl4—]中阳离子Sb为+3价,符合N族元素的价键规律,阴离子Ga核外3个电子与3个Cl原子形成共用电子对后,含有1个空的P轨道,可以结合1个氯离子形成8电子稳定结构,所以该离子化合物最可能的结构组成为b;(5)PCl4+和PCl6-之间的最短距离为晶胞中心到顶点的距离,晶胞边长为apm,所以PCl4+和PCl6-之间的最短距离为
,两个Sb原子中一个形成四个单键,另一个形成3个单键且有1对孤对电子,所以两个Sb原子的杂化轨道类型皆为sp3;NH3和CH3-含有相同的原子数和价电子数,所以与CH3-互为等电子体的分子是NH3。(3)I3+中心I原子外层有6个电子,其中两个分别和两端I原子生成共价键,剩余4个电子是两对孤对电子,于是中心I原子有4对价电子对,其中两对成键电子对,两对孤对电子对.四对电子对是sp3杂化,空间构型是V型;(4)[SbCl2+][GaCl4—]中阳离子Sb为+3价,符合N族元素的价键规律,阴离子Ga核外3个电子与3个Cl原子形成共用电子对后,含有1个空的P轨道,可以结合1个氯离子形成8电子稳定结构,所以该离子化合物最可能的结构组成为b;(5)PCl4+和PCl6-之间的最短距离为晶胞中心到顶点的距离,晶胞边长为apm,所以PCl4+和PCl6-之间的最短距离为![]() pm;根据均摊原则,1个晶胞含有PCl4+、1个PCl6-,晶胞的化学式是P2Cl10,晶胞的摩尔质量是417g/mol;1个晶胞的体积是
pm;根据均摊原则,1个晶胞含有PCl4+、1个PCl6-,晶胞的化学式是P2Cl10,晶胞的摩尔质量是417g/mol;1个晶胞的体积是![]() cm-3;晶体摩尔质量是
cm-3;晶体摩尔质量是![]()
![]() ;
;


科目:高中化学 来源: 题型:
【题目】某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
A. 只有④ B. ②③ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组模拟工业生产制取HNO3设计下图所示装置,其中a为一个可持续鼓入空气的橡皮球。请回答下列问题。
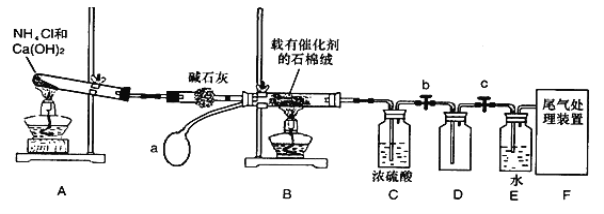
(1)写出装置B中主要反应的化学方程式 ________________________。
(2)装置E中主要反应的化学方程式______________________________。
(3)装置C中浓硫酸的作用是________________________________。
(4)请你帮助该化学小组设计实验室制取NH3的另一方案_________________________。
(5)装置D中的主要作用是 _______________________。
(6)干燥管中的碱石灰用于干燥NH3,某同学思考是否可用无水氯化钙代替碱石灰,并设计下图所示装置(仪器固定装置省略,挤出气体的气球紧套在玻璃管一端,玻璃管插在单孔橡胶塞上)进行验证。实验步骤如下:

①用烧瓶收集满干燥的氨气,立即塞上如图所示的橡胶塞。
②正立烧瓶,使无水氯化钙固体滑入烧瓶底部,摇动,可以观察到的现象是______,由此,该同学得出结论:不能用CaCl2代替碱石灰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知烯烃能被酸性KMnO4溶液氧化 。某烃的分子式为C11H20,1 mol该烃在催化剂作用下可以吸收2 mol H2;用热的酸性KMnO4溶液氧化,得到下列三种有机物:
。某烃的分子式为C11H20,1 mol该烃在催化剂作用下可以吸收2 mol H2;用热的酸性KMnO4溶液氧化,得到下列三种有机物:![]()
 ;HOOC—CH2CH2—COOH。由此推断该烃可能的结构简式为_________________________________。
;HOOC—CH2CH2—COOH。由此推断该烃可能的结构简式为_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列烷烃的命名是否正确?若有错误加以改正,把正确的名称填在横线上:
(1) 2-乙基丁烷 _____________________________________;
2-乙基丁烷 _____________________________________;
(2)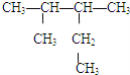 3,4-二甲基戊烷 ________________________________;
3,4-二甲基戊烷 ________________________________;
(3)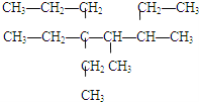 5-甲基-4,6三乙基庚烷 ____________________。
5-甲基-4,6三乙基庚烷 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液一定呈酸性的是( )
A.c(H+)=c(OH-)=10-6B.PH<7的溶液
C.c(H+)>c(OH-)的溶液D.使紫色石蕊试液呈蓝色的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定硫酸铜晶体中结晶水含量时,下列情况有可能造成测试结果偏高的是( )
A.加热后在空气中冷却称量固体B.晶体中含有加热易挥发的杂质
C.实验所取晶体已有部分脱水D.晶体加热时脱水不完全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com