
【题目】下列叙述正确的是
A. 常温下,78 g Na2O2中含有的阴离子数是2NA
B. 标况下,22.4 L CCl4含有的共价键数是4NA
C. 2.4g镁在足量氧气中燃烧,转移的电子数是0.1NA
D. 铁铝混合物与一定量稀盐酸反应生成1 mol H2时,转移电子数是2NA
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】![]() 盐酸与
盐酸与![]() 溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。
溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和热。

回答下列问题:
(1)从实验装置上看,图中尚缺少一种玻璃仪器,这种玻璃仪器的名称是____________________。能否改用铜丝_______(填“能、否”),原因是____________________________
(2)大烧杯上如不盖硬纸板,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(3)实验中改用![]() 盐酸跟
盐酸跟![]() 溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
溶液进行反应,与上述实验相比,所放出的热量__________(填“偏大”“相等”或“偏小”),所求中和热__________(填“相等”或“不相等”)。
(4)用相同浓度和体积的氨水代替![]() 溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
溶液进行上述实验,测得的中和热数值会__________(填“偏大”“偏小”或“无影响”)。
(5)取![]() 溶液和
溶液和![]() 硫酸溶液进行实验,实验数据如下表。
硫酸溶液进行实验,实验数据如下表。
温度 实验次数 | 起始温度 | 终止温度
| 温度差平均值
| ||
|
| 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _________________ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
则中和热![]() __________(取小数点后一位。)(本题中
__________(取小数点后一位。)(本题中![]() 溶液和硫酸溶液的密度均取
溶液和硫酸溶液的密度均取![]() ,中和后生成溶液的比热容取
,中和后生成溶液的比热容取![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制100 mL 1.0 ![]()
![]() 的NaOH溶液,下列情况会导致溶液浓度偏低的是( )
的NaOH溶液,下列情况会导致溶液浓度偏低的是( )
A. 容量瓶使用前经蒸馏水清洗后没有干燥
B. 配制过程中,未用蒸馏水洗涤烧杯和玻璃棒
C. 俯视确定凹液面与刻度线相切
D. 用敞口容器称量NaOH且时间过长
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. 酸性高锰酸钾溶液与稀草酸反应:5C2O42-+2MnO4-+16H+===2Mn2++10CO2+8H2O
C. AgCl的悬浊液中滴加Na2S溶液:2AgCl+S2-===Ag2S+2Cl-
D. NH4HCO3溶液加入过量NaOH溶液加热:NH4++OH-===NH3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
[实验目的]制取乙酸乙酯
[实验原理]甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯,其中浓硫酸除了做吸水剂和脱水剂的作用外还有_________;
[装置设计]甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,我选择的装置是__(选填“甲”或“乙”).丙同学将甲装置中的玻璃管改成了球形干燥管除起冷凝作用外,它的另一重要作用是_________;
[实验步骤](1)按选择的装置组装仪器,在试管中先加入3mI乙醇,2m1冰醋酸,并在摇动下缓缓加入2mI浓硫酸充分摇匀,(2)将试管固定在铁架上;(3)在试管②中加入适量的饱和Na2CO3溶液;(4)用酒精灯对试管①加热;(5)当观察到试管②中有明显现象时停止实验。

[问题讨论]a.根据试管②中观察到的现象,可知乙酸乙酯的物理性质有:无色油状液体、____;
b.试管②中饱和Na2CO3的作用是溶解乙醇、降低乙酸乙酯的溶解度还有______的作用;
c.从试管②中分离出乙酸乙酯的实验操作是______;
d、生成乙酸乙酯的化学反应方程______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各图为几种晶体或晶胞的构型示意图。
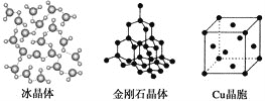
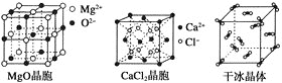
请回答下列问题:
(1)这些晶体中,粒子之间以共价键结合形成的晶体是_______________________。
(2)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为_________。
(3)NaCl晶胞与MgO晶胞相同,NaCl晶体的晶格能________(填“大于”或“小于”)MgO晶体的晶格能,原因是___________________________________________。
(4)每个Cu晶胞中实际占有________个Cu原子,CaCl2晶体中Ca2+的配位数为________。
(5)冰的熔点远高于干冰的重要原因是___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于数以千万计的化学物质和为数更多的化学反应,分类的作用几乎是无可替代的。下列物质分类的正确组合是( )
混合物 | 化合物 | 单质 | 盐 | |
A | 盐酸 | NaOH溶液 | 石墨 | 食盐 |
B | 生理盐水 | KNO3晶体 | O3 | 纯碱 |
C | 氢氧化铁胶体 | 澄清石灰水 | 铁 | 石灰石 |
D | CuSO4·5H2O | CaCl2 | 水银 | CaO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下的定容密闭容器中,进行可逆反应:A(s)+2B(g)![]() C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
C(g)+D(g),当下列物理量不发生变化时: ①混合气体的密度 ②容器内气体的压强 ③混合气体的平均相对分子质量 ④B的物质的量浓度。则能表明该反应一定已达到平衡状态的是( )
A. 只有④ B. ②③ C. ②③④ D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:-5.5 ℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:

为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①___ | ②___ |
制备纯净NO | Cu | ③___ | ④___ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:

①装置连接顺序为a→________(按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是____________。
③装置Ⅶ的作用是____________。
④装置Ⅷ中吸收尾气时,NOCl发生反应的化学方程式为________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下该混酸可生成亚硝酰氯和氯气, 该反应的化学方程式为__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com