
【题目】烟气脱硫能有效减少二氧化硫的排放。实验室用粉煤灰(主要含Al2O3、SiO2等)制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液,并用于烟气脱硫研究。
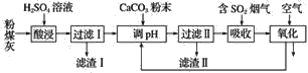
(1)酸浸时反应的化学方程式为_______________________________________________;滤渣Ⅰ的主要成分为________(填化学式)。
(2)滤渣Ⅱ的主要成分为________(填化学式);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为_________________________________________________________________。
(3)吸收烟气中SO2的化学方程式为Al2(SO4)3·Al2O3+3SO2=Al2(SO4)3·Al2(SO3)3。通入空气氧化,发生反应的化学方程式为_______________________________________________________。
【答案】Al2O3+3H2SO4=Al2(SO4)3+3H2O SiO2 CaSO4·2H2O(或CaSO4) 2Al2(SO4)3+3CaCO3+6H2O=Al2(SO4)3·Al2O3+3CaSO4·2H2O+3CO2↑[或2Al2(SO4)3+3CaCO3=Al2(SO4)3·Al2O3+3CaSO4+3CO2↑] 2Al2(SO4)3·Al2(SO3)3+3O2=4Al2(SO4)3[或2Al2(SO3)3+3O2=2Al2(SO4)3]
【解析】
(1)明确氧化铝为两性氧化物,能够与酸反应,二氧化硅为酸性氧化物,不能与硫酸反应;
(2)明确加入碳酸钙的作用以及硫酸铝溶液的性质;
(3)明确硫及其化合物的性质尤其是+4价硫的还原性等。
(1)酸浸时Al2O3与硫酸发生复分解反应,反应的化学方程式为Al2O3+3H2SO4=Al2(SO4)3+3H2O;SiO2等不能与酸反应,所以滤渣Ⅰ的主要成分是SiO2。
(2)在滤液中含有硫酸铝和过量的硫酸,当向其中加入CaCO3时,会发生复分解反应:CaCO3+H2SO4=CaSO4+CO2↑+H2O;由于硫酸钙微溶于水,所以滤渣Ⅱ的主要成分为CaSO4(或CaSO4·2H2O);制备碱式硫酸铝[Al2(SO4)3·Al2O3]溶液的化学方程式为2Al2(SO4)3+3CaCO3+6H2O=Al2(SO4)3·Al2O3+3CaSO4·2H2O+3CO2↑或2Al2(SO4)3+3CaCO3=Al2(SO4)3·Al2O3+3CaSO4+3CO2↑。
(3)通入空气氧化,空气中的氧气能够把Al2(SO3)3氧化为Al2(SO4)3,发生反应的化学方程式为2Al2(SO4)3·Al2(SO3)3+3O2=4Al2(SO4)3或2Al2(SO3)3+3O2=2Al2(SO4)3。


科目:高中化学 来源: 题型:
【题目】反应A2+3B2 =2AB3在2L的密闭容器中进行,5s后,A2的物质的量增加了0.3mol,则此反应的平均速率可表示为:
A.v (A2)=0.01 mol/(L·s)B.v (B2)=0.08 mol/(L·s)
C.v (AB3)=0.03 mol/(L·s )D.v (AB3)=0.06 mol/(L·s )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够确定一溶液中一定含有![]() 的实验事实是( )
的实验事实是( )
A.取少量试样溶液,加入用盐酸酸化过的BaCl2溶液有白色沉淀生成
B.取少量试样溶液,加入用盐酸酸化过的Ba(NO3)2溶液,有白色沉淀生成
C.取少量试样溶液,加入足量盐酸无沉淀,加入BaCl2溶液,有白色沉淀生成
D.取少量试样溶液,加入BaCl2溶液有白色沉淀生成,再加稀盐酸,沉淀不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以含锂电解铝废渣(主要成分为LiF、AlF3、NaF,少量CaO等)为原料,生产高纯度LiOH的工艺流程如图:(已知:常温下,LiOH可溶于水,Li2CO3微溶于水)

(1)含锂电解铝废渣与浓硫酸在200~400℃条件下反应2h。“滤渣1”主要成分是___(填化学式)。
(2)“过滤2”需要趁热在恒温装置中进行,否则会导致Li2SO4的收率下降,原因是___。
(已知部分物质的溶解度数据见下表)
温度/℃ | Li2SO4/g | Al2(SO4)3/g | Na2SO4/g |
0 | 36.1 | 31.2 | 4.9 |
10 | 35.4 | 33.5 | 9.1 |
20 | 34.8 | 36.5 | 19.5 |
30 | 34.3 | 40.4 | 40.8 |
40 | 33.9 | 45.7 | 48.8 |
(3)40°C下进行“碱解”,得到粗碳酸锂与氢氧化铝的混合滤渣,生成氢氧化铝的离子方程式为___;若碱解前滤液中c(Li+)=4molL-1,加入等体积的Na2CO3溶液后,Li+的沉降率到99%,则“滤液2”中c(CO32-)=___molL-1。[Ksp(Li2CO3)=1.6×10-3]
(4)“苛化”过程,若氧化钙过量,则可能会造成___。
(5)整个工艺流程中可以循环利用的物质有___。
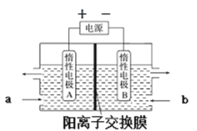
(6)“电解”原理如图所示。“碳化”后的电解液应从(填“a”或“b”)___口注入。阴极的电极反应式为___。
(7)高纯度LiOH可转化为电池级Li2CO3。将电池级Li2CO3和C、FePO4高温下反应,生成LiFePO4和一种可燃性气体,该反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列4组物质,能起反应的写出化学方程式;属于离子反应的,还要写出离子方程式;不能起反应的,说明不能起反应的原因。
(1)硫酸溶液与氯化钡溶液:_______________________________________;
(2)稀硫酸与碳酸钠溶液:_______________________________________;
(3)硝酸钠溶液与氯化钾溶液:_______________________________________;
(4)碳酸钙和盐酸:_______________________________________________________;
(5)氢氧化钾溶液和醋酸(CH3COOH)溶液:___________________________________;
(6)三氯化铁溶液和氢氧化钾溶液:__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将溶液(或气体)Y逐滴加入(或通入)一定量的溶液X中(下表),产生沉淀的物质的量(用纵坐标表示)与加入Y物质的量(用横坐标表示)的关系如图所示,则符合图中所示关系的一组物质是

A | B | C | D | |
X |
|
|
|
|
Y |
|
| NaOH | HCl |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种双电子介体电化学生物传感器,用于检测水体急性生物毒性,其工作原理如图。下列说法正确的是( )
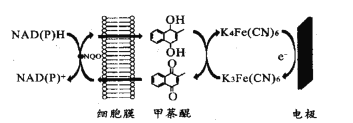
A.图中所示电极为阳极,其电极反应式为K4Fe(CN6)-e-=K3Fe(CN)6
B.甲荼醌在阴极发生氧化反应
C.工作时K+向图中所示电极移动
D.NAD(P)H转化为NAD(P)+的过程失去电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备一瓶纯净氯气的反应装置如图所示。关于实验操作或叙述正确的是( )
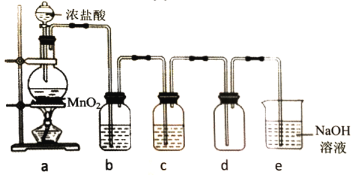
A.a中圆底烧瓶中需加入碎瓷片
B.b、c中所盛试剂依次为浓硫酸、饱和食盐水
C.d中黄绿色气体从下往上逐渐充满整个集气瓶
D.e中NaOH溶液可用浓氨水代替
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)![]() C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
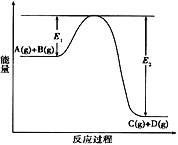
(1)该反应是___________反应(填“吸热”“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率______(填“增大”、“减小”或“不变”),原因_____。
(3)反应体系中加入催化剂对反应热是否有影响?_________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com