


| a2b2-5a1b1 |
| 2b0 |
| a2b2-5a1b1 |
| 2b0 |
 ,
, ;
;| a2b2×10-3 |
| 2 |
| 5a1b1×10-3 |
| 2 |
| 5a1b1×10-3 |
| 2 |
| a2b2×10-3 |
| 2 |
| 5a1b1×10-3 |
| 2 |
| a2b2×10-3 |
| 2 |
| 5a1b1×10-3 |
| 2 |
| a2b2-5a1b1 |
| 2b0 |
| a2b2-5a1b1 |
| 2b0 |


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源:物理教研室 题型:043
抗击:“非典”期间,过氧乙酸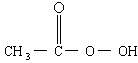 是广为使用的消毒剂.它可由
是广为使用的消毒剂.它可由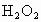 和冰醋酸反应制取,所以在过氧乙酸中常含有残留的
和冰醋酸反应制取,所以在过氧乙酸中常含有残留的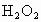 .测定产品中过氧乙酸浓度
.测定产品中过氧乙酸浓度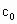 .涉及下列反应:
.涉及下列反应:
①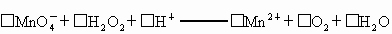
②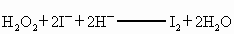
③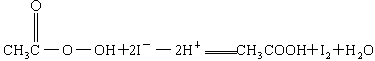
④
请回答以下问题:
(1)配平反应①的离子方程式(配乎化学计量数填入以下方框内):

(2)用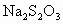 标准溶液滴定
标准溶液滴定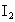 时(反应④)选用的指示剂是__________.
时(反应④)选用的指示剂是__________.
(3)取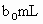 待测液,用硫酸使溶液酸化,再用浓度为
待测液,用硫酸使溶液酸化,再用浓度为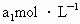 标准溶液滴定其中的
标准溶液滴定其中的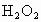 ,耗用的
,耗用的 体积为
体积为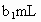 (反应①,滴定过程中
(反应①,滴定过程中 不与过氧乙酸反应).
不与过氧乙酸反应).
另取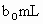 待测液,加入过量的KI,并用硫酸使溶液,酸化,此时过氧乙酸和残留的
待测液,加入过量的KI,并用硫酸使溶液,酸化,此时过氧乙酸和残留的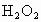 都能跟KI反应生成
都能跟KI反应生成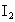 (反应②和③).再用浓度为
(反应②和③).再用浓度为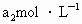 的
的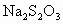 标准溶液滴定生成的
标准溶液滴定生成的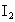 ,耗用
,耗用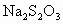 溶液体积为
溶液体积为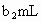 .
.
请根据上述实验数据计算过氧乙酸的浓度(用含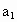 、
、 、
、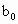 、
、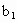 、
、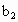 的代数式表示).
的代数式表示).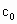 =__________.
=__________.
(4)为计算待测液中过氧乙酸的浓度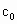 ,加入的KI的质量已过量,但没有准确称量,是否影响测定结果______(填“是”或“否”).
,加入的KI的质量已过量,但没有准确称量,是否影响测定结果______(填“是”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:
①_____![]() +_____H2O2+______H+——_____Mn2++______O2+______H2O
+_____H2O2+______H+——_____Mn2++______O2+______H2O
②H2O2+2I-+2H+====I2+2H2O
③CH3COOOH+2I-+2H+====CH3COOH+I2+H2O
④I2+2![]() ====S4O62-+2I-
====S4O62-+2I-
请回答以下问题:
(1)配平反应①的离子方程式(配平化学计量数依次填在下面所给直线上):
![]() +_____H2O2+_____H+——______Mn2++_____O2+_____H2O
+_____H2O2+_____H+——______Mn2++_____O2+_____H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中,KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(反应②和③)。再用浓度为a2 mol·L-1的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度。
c0=________(用含a1、a2、b0、b1、b2的代数式表示)。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2013届安徽省太湖二中高三上学期期末前月考化学试卷(带解析) 题型:填空题
抗击“非典”期间,过氧乙酸( )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4+□H2O2+□H+ ═□Mn2++□O2十□H2O
② H2O2+2 +2H+ ═ I2+2H2O
+2H+ ═ I2+2H2O
④ I2+2S2O32-═S4O62-+2I-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO-4+□H2O2+□H+ ═ □Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是_____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省高三下学期第一次模拟考试化学试卷 题型:填空题
(8分)抗击“非典”期间,过氧乙酸( 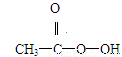 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4-+□H2O2+□H+ = □Mn2++□O2十□H2O
②
H2O2+2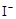 +2H+ = I2+2H2O
+2H+ = I2+2H2O
③
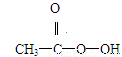 +2
+2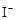 +2H+ = CH3COOH+I2+H2O
+2H+ = CH3COOH+I2+H2O
④ I2+2S2O32- = 2I-+S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
MnO4-+ H2O2+ H+ === Mn2++ O2十 H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是________________________
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·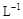 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2
mol·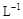 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ___________ 。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com