
抗击“非典”期间,过氧乙酸( )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4+□H2O2+□H+ ═□Mn2++□O2十□H2O
② H2O2+2 +2H+ ═ I2+2H2O
+2H+ ═ I2+2H2O
④ I2+2S2O32-═S4O62-+2I-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
□MnO-4+□H2O2+□H+ ═ □Mn2++□O2十□H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是_____________________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol· 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol·
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KmnO4不与过氧乙酸反应)。另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2 mol· 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ________________________。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
(1)2MnO4-+5H2O2+6H+=2Mn2++5O2十8H2O
(2)淀粉溶液 (3) (4)否
(4)否
解析试题分析:(1)根据方程式可知,Mn元素的化合价从+7价较低到+2价,得到5个电子。双氧水中氧元素的化合价从-1价升高到0价,失去1个电子,所以根据电子的得失守恒可知,氧化剂与还原剂的物质的量之比是2:5,则配平后的方程式是2MnO4-+5H2O2+6H+=2Mn2++5O2十8H2O。
(2)由于碘遇淀粉显蓝色,所以用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是淀粉溶液。
(3)根据反应①可知,溶液中双氧水的物质的量是 ,则根据反应②可知,双氧水和碘化钾反应生成的单质碘的物质的量是
,则根据反应②可知,双氧水和碘化钾反应生成的单质碘的物质的量是 。根据反应④可知,反应中生成的单质碘的物质的量共计是
。根据反应④可知,反应中生成的单质碘的物质的量共计是 ,所以过氧乙酸与碘化钾反应生成的单质碘的物质的量是
,所以过氧乙酸与碘化钾反应生成的单质碘的物质的量是 ,所以根据③反应可知,过氧乙酸的物质的量是
,所以根据③反应可知,过氧乙酸的物质的量是 ,所以过氧乙酸的浓度是
,所以过氧乙酸的浓度是 mol/L。
mol/L。
(4)根据(3)中的分析可知,测定结果与碘化钾的质量没有关系,所以不会影响结果。
考点:考查氧化还原反应方程式的配平、指示剂的选择、物质浓度的测定
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养与解题方法的指导与训练,有利于培养学生的逻辑推理能力,提高学生规范、严谨的实验设计能力。该题主要是以实验基本操作为中心,通过是什么、为什么和怎样做重点考查实验基本操作的规范性和准确性及灵活运用知识解决实际问题的能力。


科目:高中化学 来源: 题型:


| a2b2-5a1b1 |
| 2b0 |
| a2b2-5a1b1 |
| 2b0 |
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:043
抗击:“非典”期间,过氧乙酸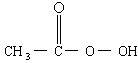 是广为使用的消毒剂.它可由
是广为使用的消毒剂.它可由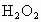 和冰醋酸反应制取,所以在过氧乙酸中常含有残留的
和冰醋酸反应制取,所以在过氧乙酸中常含有残留的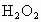 .测定产品中过氧乙酸浓度
.测定产品中过氧乙酸浓度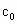 .涉及下列反应:
.涉及下列反应:
①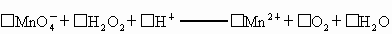
②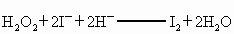
③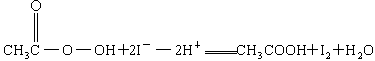
④
请回答以下问题:
(1)配平反应①的离子方程式(配乎化学计量数填入以下方框内):

(2)用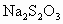 标准溶液滴定
标准溶液滴定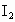 时(反应④)选用的指示剂是__________.
时(反应④)选用的指示剂是__________.
(3)取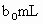 待测液,用硫酸使溶液酸化,再用浓度为
待测液,用硫酸使溶液酸化,再用浓度为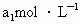 标准溶液滴定其中的
标准溶液滴定其中的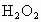 ,耗用的
,耗用的 体积为
体积为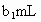 (反应①,滴定过程中
(反应①,滴定过程中 不与过氧乙酸反应).
不与过氧乙酸反应).
另取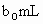 待测液,加入过量的KI,并用硫酸使溶液,酸化,此时过氧乙酸和残留的
待测液,加入过量的KI,并用硫酸使溶液,酸化,此时过氧乙酸和残留的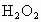 都能跟KI反应生成
都能跟KI反应生成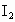 (反应②和③).再用浓度为
(反应②和③).再用浓度为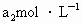 的
的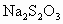 标准溶液滴定生成的
标准溶液滴定生成的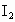 ,耗用
,耗用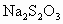 溶液体积为
溶液体积为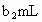 .
.
请根据上述实验数据计算过氧乙酸的浓度(用含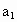 、
、 、
、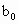 、
、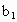 、
、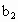 的代数式表示).
的代数式表示).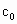 =__________.
=__________.
(4)为计算待测液中过氧乙酸的浓度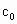 ,加入的KI的质量已过量,但没有准确称量,是否影响测定结果______(填“是”或“否”).
,加入的KI的质量已过量,但没有准确称量,是否影响测定结果______(填“是”或“否”).
查看答案和解析>>
科目:高中化学 来源: 题型:
①_____![]() +_____H2O2+______H+——_____Mn2++______O2+______H2O
+_____H2O2+______H+——_____Mn2++______O2+______H2O
②H2O2+2I-+2H+====I2+2H2O
③CH3COOOH+2I-+2H+====CH3COOH+I2+H2O
④I2+2![]() ====S4O62-+2I-
====S4O62-+2I-
请回答以下问题:
(1)配平反应①的离子方程式(配平化学计量数依次填在下面所给直线上):
![]() +_____H2O2+_____H+——______Mn2++_____O2+_____H2O
+_____H2O2+_____H+——______Mn2++_____O2+_____H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是________。
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·L-1的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中,KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟KI反应生成I2(反应②和③)。再用浓度为a2 mol·L-1的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度。
c0=________(用含a1、a2、b0、b1、b2的代数式表示)。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果______(填“是”或“否”)。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年山西省高三下学期第一次模拟考试化学试卷 题型:填空题
(8分)抗击“非典”期间,过氧乙酸( 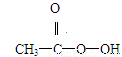 )是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
)是广为使用的消毒剂。它可由H2O2和冰醋酸反应制取,所以在过氧乙酸中常含有残留的H2O2。测定产品中过氧乙酸浓度c0。涉及下列反应:
① □MnO4-+□H2O2+□H+ = □Mn2++□O2十□H2O
②
H2O2+2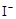 +2H+ = I2+2H2O
+2H+ = I2+2H2O
③
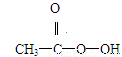 +2
+2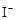 +2H+ = CH3COOH+I2+H2O
+2H+ = CH3COOH+I2+H2O
④ I2+2S2O32- = 2I-+S4O62-
请回答以下问题:
(l)配平反应①的离子方程式(配平系数填人以下方框内):
MnO4-+ H2O2+ H+ === Mn2++ O2十 H2O
(2)用Na2S2O3标准溶液滴定I2时(反应④)选用的指示剂是________________________
(3)取b0 mL待测液,用硫酸使溶液酸化,再用浓度为a1 mol·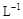 的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
的KMnO4标准溶液滴定其中的H2O2,耗用的KMnO4体积为b1 mL(反应①,滴定过程中KMnO4不与过氧乙酸反应)。
另取b0 mL待测液,加入过量的KI,并用硫酸使溶液酸化,此时过氧乙酸和残留的H2O2都能跟 KI反应生成 I2(反应②和③)。再用浓度为a2
mol·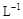 的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
的Na2S2O3标准溶液滴定生成的I2,耗用Na2S2O3溶液体积为b2 mL。
请根据上述实验数据计算过氧乙酸的浓度(用含a1、a2、b0、b1、b2的代数式表示)。
c0= ___________ 。
(4)为计算待测液中过氧乙酸的浓度c0,加入的KI的质量已过量但没有准确称量,是否影响测定结果 _______________(填是或否)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com