
分析 (1)NaHCO3加热分解生成碳酸钠;
(2)碳酸钠与水、二氧化碳反应生成碳酸氢钠;
(3)碳酸氢钠与硫酸反应生成硫酸钠、水、二氧化碳;
(4)Al与NaOH溶液反应,而Fe不能,则加足量NaOH溶解后过滤可除杂;
(5)氧化铝与NaOH反应,而氧化铁不能.
解答 解:(1)NaHCO3加热分解生成碳酸钠,分离方法为加热,反应为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:加热;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)碳酸钠与水、二氧化碳反应生成碳酸氢钠,则试剂为足量二氧化碳,离子反应为CO32-+CO2+H2O=2HCO3-,
故答案为:足量二氧化碳;CO32-+CO2+H2O=2HCO3-;
(3)碳酸氢钠与硫酸反应生成硫酸钠、水、二氧化碳,则试剂为稀硫酸,离子反应为HCO3-+H+=CO2↑+H2O,
故答案为:稀硫酸;HCO3-+H+=CO2↑+H2O;
(4)Al与NaOH溶液反应,而Fe不能,则加足量NaOH溶解后过滤可除杂,则试剂为NaOH溶液,离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:NaOH溶液;2Al+2OH-+2H2O═2AlO2-+3H2↑;
(5)氧化铝与NaOH反应,而MgO不能,则试剂为NaOH溶液,反应为Al2O3+2OH-═2AlO2-+H2O,
故答案为:NaOH溶液;Al2O3+2OH-═2AlO2-+H2O.
点评 本题考查物质分离提纯方法和选择及金属及化合物的性质,为高频考点,把握物质的性质及性质差异为解答的关键,注意除杂不能引入新杂质,题目难度不大.


科目:高中化学 来源: 题型:解答题


 .
. .
.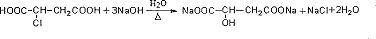 .
. 等.
等.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 或
或 .
. 、
、 、
、 ;比烃A少2个碳原子的同系物有4种同分异构体,其中能和H2发生加成反应生成2-甲基丙烷的同分异构体的名称是2-甲基丙烯.
;比烃A少2个碳原子的同系物有4种同分异构体,其中能和H2发生加成反应生成2-甲基丙烷的同分异构体的名称是2-甲基丙烯.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 铊既能与强酸反应又能与强碱反应 | B. | 能生成+3价的化合物 | ||
| C. | Tl(OH)3与Al(OH)3一样是两性氢氧化物 | D. | Tl(OH)3的碱性比Al(OH)3强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①②均为放热反应 | |
| B. | 反应①②转移的电子数相同 | |
| C. | 若用标准状况下4.48L CH4还原NO2至N2,放出的热量是173.4kJ | |
| D. | 由反应①可推知:CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(l)△H=-akJ•mol-1,a<574 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com