
【题目】某非金属X的最低负价为﹣m.它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的分子式为( )
A.H2b﹣8+mXOb
B.H2b﹣m+8XOb
C.H2b﹣8﹣mXOb
D.H2b+8+mXOb
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W有如下所示的转化关系,且△H=△H1+△H2 , 则X、Y可能是( )
①C,CO ②S,SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2 . ![]()
A.①②③④⑤
B.②④⑤
C.①③④
D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质或离子在指定分散系中能大量共存的是( )
A.Ca(ClO)2溶液中:K+、Na+、NO3-、Cl-
B.Fe(OH)3胶体中:Na+、H+、Cl-、I-
C.空气中:H2、HCl、NO、NH3
D.无色透明溶液中:K+、Na+、MnO4-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘,有甲、乙两种实验方案如图1:已知:3I2+6NaOH=5NaI+NaIO3+3H2O.请回答: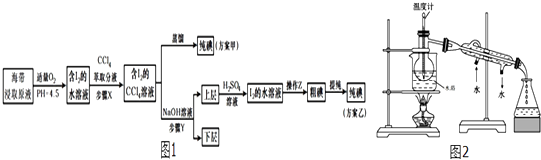
(1)步骤X使用分液漏斗前须检漏,检漏方法为 .
(2)用图所示装置进行蒸馏.指出如图所示实验装置 中的任意两处错误:① .
(3)进行上述操作时,使用水浴加热更好的原因是;最后碘晶体在里聚集.
(4)下列有关步骤Y的说法,正确的是 .
A.应控制 NaOH 溶液的浓度和体积
B.将碘转化成离子进入水层
C.主要是除去海带浸取原液中的有机杂质
D.NaOH 溶液可以由乙醇代替
(5)方案乙在上层溶液中加入H2SO4溶液得到I2的水溶液发生的反应方程式是:;
(6)操作Z的名称是 .
(7)工业中采用方案乙从海带中提取碘,方案甲中采用蒸馏不合理,理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 .
(2)烧杯间填满碎纸条的作用是 .
(3)大烧杯上如不盖硬纸板,求得的中和热数值(填“偏大、偏小、无影响”)
(4)如果用60mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量(填“相等、不相等”),所求中和热(填“相等、不相等”),简述理由
(5)用相同浓度和体积的氨水(NH3H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会;(填“偏大”、“偏小”、“无影响”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是
类别 组合 | 酸性氧化物 | 碱性氧化物 | 酸 | 碱 | 盐 |
A | CO2 | A12O3 | H2SO4 | KOH | NaHCO3 |
B | CO | Na2O | HC1 | NaOH | NaCl |
C | SO2 | Na2O2 | CH3COOH | Na2CO3 | CaF2 |
D | SO3 | CaO | HNO3 | Ca(OH)2 | CaCO3 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,平衡pH值随溶液体积变化的曲线如图所示.据图判断正确的是( ) 
A.Ⅱ为盐酸稀释时的pH值变化曲线
B.b点溶液的导电性比c点溶液的导电性强
C.a点Kw的数值比c点Kw的数值大
D.b点酸的总浓度大于a点酸的总浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化镁(Mg3N2)是工业上常用的脱硫剂.为了测定ag Mg3N2样品中Mg3N2的纯度,某同学设计了如图装置(样品中的杂质不与水反应,夹持装置已略去). 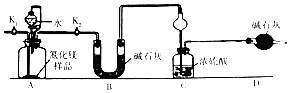
(1)装置A中发生反应的化学方程式为
(2)装置C中球形干燥管的作用是
(3)组装好实验装置后,首先应 , 再加入实验药品,打开(填“K1”或“K2”,后同),关闭 , 打开分液漏斗活塞,加入水,至不再产生气体.打开所有止水夹后通入氮气一段时间,测量装置(填“B”“C”或“D”)反应前后的质量变化为bg,通入氮气的目的是;
(4)Mg3N2的纯度是(用含a、b的式子表示)
(5)若去掉装置D,则导致测定结果(填“偏高”、“偏低”或“无影响”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: 
(1)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为 .
①0.20molL﹣1 ②0.12molL﹣1 ③0.10molL﹣1 ④0.08molL﹣1
(2)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25molL﹣1),请在如图中画出第5分钟末达到此平衡时NH3浓度的变化曲线 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com