
分析 A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则C是O元素;C与F同主族,则F是S元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,据此解答.
解答 解:A、B、C、D、E、F六种短周期元素,其原子序数依次增大,C元素的原子最外层电子数是次外层电子数的三倍,原子只能有2个电子层,最外层电子数为6,则C是O元素;C与F同主族,则F是S元素;D与E和F同周期,即处于第三周期,D是所在周期原子半径最大的主族元素,则D是Na元素;E的原子序数大于钠小于硫,所以E的单质是固体;六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体,B的原子序数小于C,且B、C处于同一周期,所以B是N元素;A的单质是气体,则A的原子序数最小,所以A是H元素,
(1)C是氧元素,氧原子核外有6个电子层,最外层有2个电子,所以其在元素周期表中的位置是第二周期第ⅥA族,
故答案为:第二周期第ⅥA族;
(2)电子层数越多离子半径越大,电子层结构相同,核电荷数越大离子半径越小,所以C、D、F三种元素形成的简单离子的半径由大到小的顺序是:S 2->O 2->Na+,
故答案为:S 2->O 2->Na+;
(3)由A、B、C三种元素以原子个数比4:2:3形成化合物X为NH4NO3,硝酸铵中所含化学键类型有离子键和共价键,用碱与铵盐反应生成氨气检验铵根离子,反应离子方程式为NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,
故答案为:离子键、共价键;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,则E为Al元素,其最高价氧化物为Al2O3,D的最高价氧化物对应水化物为NaOH,二者反应离子方程式为:Al2O3+2OH-=2AlO2-+H2O;
若E是非金属元素,其单质在电子工业中有重要应用,则E是Si元素,离子反应方程式为:Si+H2O+2OH-=SiO3 2-+2H2↑,
故答案为:Al2O3+2OH-=2AlO2-+H2O;Si+H2O+2OH-=SiO32-+2H2↑.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,综合考查学生分析能力、逻辑推理能力及对知识的迁移运用,需要学生具备扎实的基础,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 乙醇的结构简式:C2H6O | |
| B. | Al3+的结构示意图: | |
| C. | CO2的电子式: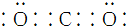 | |
| D. | NaHCO3的电离方程式:NaHCO3═Na++H++CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用图1示装置制备Cl2 | |
| B. | 将混合气体通过装有NaOH溶液的洗气瓶除去Cl2中混有的HCl | |
| C. | 用图2示装置分离CH3COOC2H5与饱和Na2CO3溶液 | |
| D. | 称取1.06 g Na2CO3固体,置于100 mL容量瓶中,加水稀释,配制0.10 mol•L-1的Na2CO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有C-H键的数目为3NA | |
| B. | 常温下,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 标准状况下22.4LSO3中含有的氧原子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 A1/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )
A1/MnO4-电池是一种高能电池,以Ga2O3为缓蚀剂,其示意图如图所示.已知电池总反应为Al+MnO4-+2H2O═Al(OH)4-+MnO2.下列说法正确的是( )| A. | 电池工作时,K+向负极移动 | |
| B. | 电池工作时,Al电极周围溶液pH增大 | |
| C. | 正极反应为MnO4-+2H2O+3e-═MnO2+4OH- | |
| D. | 电池工作时,电子由Al经溶液流向Ni |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(5) | B. | (1)(3)(5) | C. | (1)(4)(5) | D. | (2)(3)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2(CO):通过灼热的CuO粉末 | B. | Na2SO4溶液(Na2CO3):加盐酸 | ||
| C. | NaCl(NH4Cl):加热 | D. | NO2(NO):通入水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 和
和 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16O2、18O3互为同位素 | |
| B. | 次氯酸的电子式为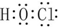 | |
| C. | 氧与氟形成的化合物(OF2)中,氧元素的化合价为-2价 | |
| D. | 一种元素可能有多种氧化物,但同种化合价只对应一种氧化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com