
| A. | 标准状况下,11.2L苯中含有C-H键的数目为3NA | |
| B. | 常温下,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.1NA | |
| C. | 常温下,56g铁片投入足量浓H2SO4中生成NA个SO2分子 | |
| D. | 标准状况下22.4LSO3中含有的氧原子数目为3NA |
分析 A、标况下苯为液态;
B、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L;
C、常温下,铁在浓硫酸中钝化;
D、标况下三氧化硫为液态.
解答 解:A、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量和C-H键的个数,故A错误;
B、pH=13的氢氧化钡溶液中,氢氧根的浓度为0.1mol/L,故1L溶液中氢氧根的物质的量为0.1mol,个数为0.1NA个,故B正确;
C、常温下,铁在浓硫酸中钝化,反应程度很小,故生成的二氧化硫分子小于NA个,故C错误;
D、标况下三氧化硫为液态,故不能根据气体摩尔体积来计算其物质的量和含有的氧原子的个数,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. | 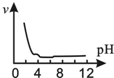 | D. | 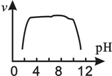 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
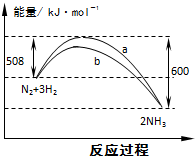
| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ•mol-1 | |
| B. | 向一密闭容器中加入1molN2和3molH2充分反应后,放出92kJ热量 | |
| C. | b曲线可能是加入催化剂时的能量变化曲线 | |
| D. | 加入正催化剂可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备Fe(OH)3胶体:0.1 mol•L-1 FeCl3溶液与0.3 mol•L-1 NaOH溶液等体积混合 | |
| B. | 验证溴原子:取C2H5Br少许与NaOH溶液共热,冷却后滴加AgNO3溶液 | |
| C. | 检验Fe2+:取少量待测液,向其中加入适量新制氯水,再滴加KSCN溶液 | |
| D. | 比较AgCl和AgI的溶解度:向2 mL 0.1 mol•L-1 NaCl溶液中滴加数滴同浓度AgNO3溶液,然后再滴入KI溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
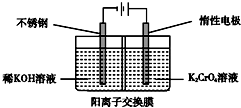
| A. | 在阴极室,发生的电极反应为2H2O+2e-═2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程中总反应的化学方程式为4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nK/nCr)为d,则此时铬酸钾的转化率为1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质.
从原子、分子水平上帮助我们认识物质构成的规律:以微粒之间不同的作用力为线索,研究不同类型物质的有关性质:从物质结构决定性质的视角预测物质的有关性质. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com