
在相同条件下,将相同物质的量的Na、Mg、Al分别加入盛有同浓度、同体积稀盐酸的甲、乙、丙三个烧杯中充分反应,生成气体的体积关系不可能是 ( )
A.甲(Na)>乙(Mg)>丙(Al) B.甲(Na)>乙(Mg)=丙(Al)
C.甲(Na)<乙(Mg)<丙(Al) D.甲(Na)=乙(Mg)=丙(Al)
科目:高中化学 来源: 题型:
氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g·L-1。请回答下列问题:
(1)甲与水反应的化学方程式是___________________________________。
(2)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式
_______________________________________________________。
有人提出生成的产物Cu中可能还混有Cu2O,请设计实验方案验证之。
(已知:Cu2O+2H+=Cu+Cu2++H2O)
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知短周期主族元素A、B在周期表中的相对位置如右图(稀有气体除外),则下列说法不正确的是
| A | |
| B |
A.A一定是第2周期元素 B.B的原子半径一定比A大 C.B的金属性一定比A强 D.A的熔沸点一定比B高
查看答案和解析>>
科目:高中化学 来源: 题型:
被称为万能还原剂的NaBH4溶于水并和水反应:NaBH4+2H2O===NaBO2+4H2↑,下列说法中正确的是(NaBH4中H为-1价) ( )
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素质量之比为1∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有机物既能发生消去反应生成相应的烯烃,又能氧化生成相应的醛的是 ( )
A.CH3OH B.HOCH2CH(CH3)2
C.(CH3)3COH D.CH3CHOHCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
14 g铜银合金与足量的某浓度的硝酸反应,将放出的气体与1.12 L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为 ( )
A.9.6 g B.6.4 g C.3.2 g D.1.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol•L-1FeCl2溶液:H+、Na+、Cl-、NO3-
B.c(OH-)=0.1 mol•L-1的溶液:K+、Na+、ClO-、NO3-
C.c(H+)=0.1 mol•L-1的溶液:K+、Na+、HCO3-、SO42-
D.与铝反应产生大量氢气的溶液:Ba2+、Na+、CO32-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
烟气的脱硫(除SO2)技术和脱硝(除NOx)技术都是环境科学研究的热点。
⑴烟气脱硫、脱硝的环境意义是 。
⑵选择性催化还原法的脱硝原理为:6NOx+4x NH3 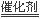 (3+2x)N2+6xH2O
(3+2x)N2+6xH2O
①上述反应中每转移3mol电子,生成标准状况下N2的体积为 L。
②已知:2H2(g)+O2(g) =2H2O (g) ΔH=-483.6 kJ·mol-1
N2(g)+3H2(g)=2NH3(g) ΔH=-92.4 kJ·mol-1
N2(g)+O2(g)=2NO(g) ΔH=-180.5kJ·mol-1
则反应6NO(g)+4NH3(g)=5N2(g)+6H2O(g)的ΔH= 。
⑶目前,科学家正在研究一种以乙烯作为还原剂的脱硝(NO)原理,其脱硝机理示意图如下图1,脱硝率与温度、负载率(分子筛中催化剂的质量分数)的关系如图2所示。
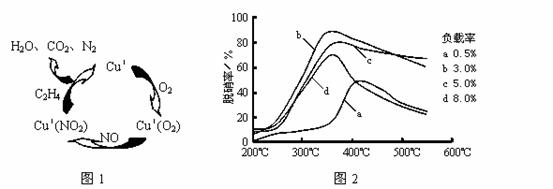
①写出该脱硝原理总反应的化学方程式: 。
②为达到最佳脱硝效果,应采取的条件是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知H—H键能为436 KJ/mol,H—N键能为391KJ/mol,根据化学方程式:
N2 + 3H2  2NH3 ΔH=—92.4 KJ/mol,则N≡N键的键能是 ( )
2NH3 ΔH=—92.4 KJ/mol,则N≡N键的键能是 ( )
A.431 KJ/mol B.946 KJ/mol C.649 KJ/mol D.869 KJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com