
【题目】保存少量金属钠的方法是( )
A. 放在冰水中 B. 放在细沙中 C. 放在水中 D. 放在煤油中
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):
![]() (浓)
(浓)![]()
![]()
试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于________(用字母代号填写)
a. 酸 b. 碱 c. 盐 d. 酸性氧化物 e. 碱性氧化物
A物质可以使酸性![]() 溶液褪色,此反应中________(填写化学式,下同)失去电子,氧化剂是__________。
溶液褪色,此反应中________(填写化学式,下同)失去电子,氧化剂是__________。
(2)一定量的铜片与100mL 18 mol/L的浓![]() 充分反应,如果该反应过程中转移了0.2mol电子,生成的
充分反应,如果该反应过程中转移了0.2mol电子,生成的![]() 的质量为_____g。
的质量为_____g。
(3)将反应后所得到的溶液与足量![]() 溶液充分反应。请写出此过程发生的反应的离子方程式:______________________。
溶液充分反应。请写出此过程发生的反应的离子方程式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是 ( )

A. 正硼酸晶体属于原子晶体
B. H3BO3分子的稳定性与氢键有关
C. 分子中硼原子最外层为8电子稳定结构
D. 含1 mol H3BO3的晶体中有3 mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第________周期,第______族;
(2)X可形成双原子分子,其分子的电子式是_________;Y和氢元素形成的10电子微粒中常见+1价阳离子为_______(填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子的水解方程式__________。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式_________________________。
(4)将0.20molYZ2和0.10molO2充入一个固定容积为5L的密闭容器中,在一定温度并有催化剂存在下,进行反应,经半分钟达到平衡,测得溶液中含YZ30.18mol,则v(O2)=________mol/(L·min);若温度不变,继续通入0.20molYZ2和0.10molO2,则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”),再次达到平衡后,________mol<n(YZ3)<_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:NH4++OH-![]() NH3↑+H2O,有一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl-中的几种,取该溶液进行如下实验:
NH3↑+H2O,有一瓶澄清的溶液,其中可能含有NH4+、K+、Mg2+、Ba2+、Al3+、Fe3+、SO42-、CO32-、NO3-、Cl-中的几种,取该溶液进行如下实验:
(1)填表(在表中的空白处填写离子符号)
步骤 | 实验步骤 | 肯定不存在的离子 |
① | 用pH试纸测得该溶液呈酸性 | ________________ |
② | 另取l0mL该溶液逐滴加入稀NaOH溶液,使溶液从酸性逐渐变为碱性,此过程中无沉淀生成 | ________________ |
③ | 向②所得的溶液中加入足量Na2CO3溶液,过滤、洗涤、干燥,得到1.97g白色固体 | ________________ |
④ | 另取l0mL该溶液,加入浓NaOH溶液并加热,收集到224mL气体A(标准状况下) | |
⑤ | 另取l0mL该溶液,加入足量稀硝酸和AgNO3溶液,产生2.87g白色沉淀 |
(2)根据以上事实,在上述离子中,该溶液肯定存在的离子有________________。
(3)气体A溶于水可配成溶液A (该溶液的密度比水小),把50g浓度为c1的浓A溶液(溶质质量分数为ω1)与V mL水混合,得到浓度为c2的稀A溶液(溶质质量分数为ω2)。若ω1=2ω2,则:
①c1_____c2,②V_________50mL(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种元素,其中A和B原子都有1个未成对电子,A+比B-少一个电子层。B原子得一个电子填入3p轨道后,3p轨道已充满,C原子的p轨道中有3个未成对电子,其气态氢化物的水溶液的pH在同族氢化物中最大,D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D 40%,且其核内质子数等于中子数,据此判断:
(1)D是_______。(填元素名称)
(2)B-的电子排布式____,A+的结构示意图____,D原子的轨道表示式______。
(3)在A、B、D三种元素的简单离子中,其离子还原性最强的是________。(填离子符号)
(4)用电子式表示化合物AB的形成过程________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:
2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
SO2 压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。

(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。
① tl 时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是________。
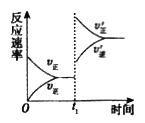
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
② 若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,______mol3)<______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为____________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是____________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:
____________________________________________________________ 。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为___________________________。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2 ![]() Fe + 2ZG
Fe + 2ZG

放电时,电池的正极反应式为_______________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com