
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:
2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
SO2 压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。

(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。
① tl 时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是________。
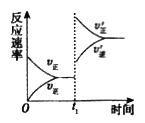
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
② 若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,______mol3)<______mol。
【答案】 1个大气压和400℃ A、C = 800 C 正向 0.36 0.4
【解析】(1)因为SO2与O2的反应是放热反应,所以选择的温度为400℃,而1个标准大气压时SO2的转化率已经很大,再增大压强,SO2的转化率提高不大,但会增加生产成本,所以选择1个标准大气压;
(2)A.保持温度和容器体积不变,O2的浓度增大,平衡正向移动,SO2的浓度减小,所以A正确;B.保持温度和容器内压强不变,充入2mol SO3 (g)相当于充入2.0molSO2和5.0molO2,新的平衡与原平衡等效,SO2的浓度不变,所以B错误;C.降低温度,平衡向放热的方向移动,而正反应为放热,所以平衡正向移动,SO2的浓度减小,所以C正确;D.在其他条件不变时,减小容器的容积,SO2的浓度瞬间增大,之后平衡向气体体积减少的方向移动,即向正反应方向移动,SO2的浓度减小,再次到达平衡时SO2的浓度仍比原来大,所以D错误;故答案为AC。
(3)平衡常数只受温度的影响,温度不变,则压强改变,平衡状态由A变到B时,则K(A)=K(B),
由图象知,体系总压强为0.10MPa时SO2的平衡转化率为0.8,则二氧化硫转化物质的量=2.0mol×0.8=1.6mol,
2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
起始:2.0mol1.0mol0
转化:1.6mol0.8mol 1.6mol
平衡:0.4mol0.2mol 1.6mol
则平衡时:c(SO2)=0.04mol/L,c(O2)=0.02mol/L,c(SO3)=0.16mol/L,
K(A)=K(B)=![]() =800;
=800;
(4)①t1时刻达到平衡后,改变一个条件使化学反应速度发生如图所示的变化分析可知,改变条件正逆反应速率都增大,且正反应速率大于逆反应速率;A.体积不变,向容器中通入少量O2 ,此时刻正反应速率增大,逆反应速率不变,随反应进行正反应速率减小,逆反应速率增大,最后达到新的平衡状态,图象中逆反应速率变化不符合,故A错误;B.体积不变,向容器中通入少量SO2,此时刻正反应速率增大,逆反应速率不变,随反应进行正反应速率减小,逆反应速率增大,最后达到新的平衡状态,图象中逆反应速率变化不符合,故B错误;C.缩小容器体积,压强增大,正逆反应速率增大,正反应是气体体积减小的反应,所以平衡正向进行,图象变化符合要求,故C正确;D.正反应是放热反应,升高温度,平衡逆向进行,正逆反应速率都增大,逆反应速率大于正反应速率,故D错误;E.体积不变,向容器中通入少量氮气,总压增大,各气体分压不变,平衡不变,故E错误;故选C;
②当生成0.18molSO3时,参加反应的氧气的物质的量为x,
2SO2(g)+O2(g)2SO3(g)
1 2
x 0.18mol
x=![]() =0.09mol,
=0.09mol,
继续通入0.20mol SO2和0.10mol O2,容器内压强增大,平衡向气体体积减小的方向移动,即向正反应方向移动;
用极限法求出n(SO3)的范围,
假设平衡不移动,此时n(SO3)=0.18×2=0.36mol,
假设0.40molSO2完全生成SO3,根据反应方程式2SO2(g)+O2(g)2SO3(g)可知,n(SO3)=0.4mol,
所以再次达到平衡时,0.36mol<n(SO3)<0.40mol。


科目:高中化学 来源: 题型:
【题目】下列制备金属单质的方法或原理正确的是( )
A. 在高温条件下,用H2还原MgO制备单质Mg
B. 在通电条件下,电解熔融Al2O3制备单质Al
C. 在通电条件下,电解饱和食盐水制备单质Na
D. 加强热,使CuO在高温条件下分解制备单质Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对相关方程式书写判定及解释正确的是
选项 | 离子方程式 | 评价 |
A | 将2molCl2通入到含1molFeI2的溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确:Cl2过量,可将Fe2+、I-均氧化 |
B | 工业上制铝:2AlCl3 | 正确:阳极氯离子放电,阴极铝粒子放电 |
C | 向AlCl3溶液中加入过量的浓氨水:Al3++4NH3·H2O= AlO2-+4NH4++2H2O | 正确:氨水过量,氢氧化铝能溶于过量的碱 |
D | 将磁性氧化铁溶于盐酸:Fe3O4+8H+=Fe3++4H2O | 错误:等式两侧电荷不守恒,生成物中应有亚铁离子 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用焰色反应,人们在烟花中有意识地加入特定金属元素,使焰火更加绚丽多彩。下列说法中正确的是
A. 非金属单质燃烧时火焰均为无色
B. NaCl与Na2CO3灼烧时火焰颜色相同
C. 焰色反应均应透过蓝色钴玻璃观察
D. 只有金属单质灼烧时火焰才有颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示是验证氯气性质的微型实验,a、b、d、e是浸有相关溶液的滤纸。向KMnO4晶体滴加一滴浓盐酸后,立即用另一培养皿扣在上面。已知:2KMnO4+16HCl―→2KCl+5Cl2↑+2MnCl2+8H2O

对实验现象的“解释或结论”正确的是 ( )
选项 | 实验现象 | 解释或结论 |
A | a处变蓝,b处变红棕色 | 氧化性:Cl2>Br2>I2 |
B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
C | d处立即褪色 | 氯气与水生成了漂白性物质 |
D | e处变红色 | 还原性:Fe2+>Cl- |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在中国珊瑚是吉祥富有的象征,一直用来制做珍贵的工艺品红珊瑚是无数珊瑚虫分泌的石灰质大量堆积形成的干支状物,呈红色是因为在海底长期积淀某种元素的化合物导致的,该元素是( )
A.CuB.SiC.FeD.Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,物质的量浓度为c mol·L-1,则下列选项不正确的是( )
A. 溶质的质量分数为w=![]()
B. 用水稀释该溶液,OH-的物质的量增加
C. 该溶液中共有6种微粒
D. 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com