
【题目】在T ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·cm-3,溶质的质量分数为w,物质的量浓度为c mol·L-1,则下列选项不正确的是( )
A. 溶质的质量分数为w=![]()
B. 用水稀释该溶液,OH-的物质的量增加
C. 该溶液中共有6种微粒
D. 上述溶液中再加入V mL水后,所得溶液溶质的质量分数大于0.5w
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,层内的H3BO3分子通过氢键相连(如下图)。下列有关说法正确的是 ( )

A. 正硼酸晶体属于原子晶体
B. H3BO3分子的稳定性与氢键有关
C. 分子中硼原子最外层为8电子稳定结构
D. 含1 mol H3BO3的晶体中有3 mol氢键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的化工原料,生产过程中SO2催化氧化生成SO3的化学反应为:
2SO2(g)+O2(g) ![]() 2SO3(g)。
2SO3(g)。
(1)实验测得SO2反应生成SO3的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择最合适的生产条件是________。
SO2 压强 转化率 温度 | 1个大气压 | 5个大气压 | 10个大气压 | 15个大气压 |
400℃ | 0.9961 | 0.9972 | 0.9984 | 0.9988 |
500℃ | 0.9675 | 0.9767 | 0.9852 | 0.9894 |
600℃ | 0.8520 | 0.8897 | 0.9276 | 0.9468 |
(2)反应2SO2(g)+O2(g) ![]() 2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
2SO3(g)达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是________(填字母)。
A.保持温度和容器体积不变,充入1molO2(g)
B.保持温度和容器体积不变,充入2mol SO3(g)
C.降低温度
D.在其他条件不变时,减小容器的容积
(3)某温度下,SO2的平衡转化率(α)与体系总压强(P)的关系如图所示。2.0 molSO2和1.0mol O2置于10L密闭容器中,反应达平衡后,体系总压强为0.10 MPa。平衡状态由A变到B时,平衡常数K(A)_____K(B)(填“>”、“<”或“=”), B点的化学平衡常数是______。

(4)在一个固定容积为5L的密闭容器中充入0.20mol SO2和0.10molO2, t1时刻达到平衡,测得容器中含SO30.18mol。
① tl 时刻达到平衡后,改变一个条件使化学反应速率发生如图所示的变化,则改变的条件是________。
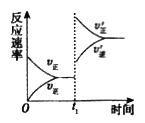
A.体积不变,向容器中通入少量O2
B.体积不变,向容器中通入少量SO2
C.缩小容器体积
D.升高温度
E.体积不变,向容器中通入少量氮气
② 若继续通入0.20mol SO2和0.10molO2,则平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”) ,再次达到平衡后,______mol3)<______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. KOH中含有离子键也含有共价键,属于离子化合物
B. HF中存在离子键,属于离子化合物
C. 含有共价键的化合物一定是共价化合物
D. 阴、阳离子间通过静电引力而形成的化学键叫做离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学──物质结构与性质】(15分)某钙钛型复合氧化物(如图),以A原子为晶胞的顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物的电阻率在有外磁场作用时较之无外磁场作用时存在巨大变化(巨磁电阻效应)。

(1)用A、B、O表示这类特殊晶体的化学式 。在图中,与A原子配位的氧原子数目为 。
(2)基态Cr原子的核外电子排布式为 ,其中电子的运动状态有 种。
(3)某些钙钛型复合氧化物能够催化NO直接分解为N2和O2,N和O的基态原子中,未成对的电子数目比为 。
(4)下表是几种碳酸盐的热分解温度和阳离子半径
碳酸盐 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 900 | 1172 | 1360 |
阳离子半径/pm | 99 | 112 | 135 |
请解释碳酸钙热分解温度最低的原因:___________________________________。
(5)用晶体的X射线衍射法可以测得阿伏伽德罗常数。对金属钙的测定得到以下结果:晶胞为面心立方最密堆积,边长为558pm。又知钙的密度为1.54g·cm-3,则1cm3钙晶体中含有 个晶胞,阿伏伽德罗常数为 (列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为____________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是____________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:
____________________________________________________________ 。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为___________________________。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2 ![]() Fe + 2ZG
Fe + 2ZG

放电时,电池的正极反应式为_______________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置进行实验,将液体a逐滴加入到固体b中,则下列叙述不正确的是

A. 若a为浓盐酸,b为KMnO4,c中盛紫色石蕊试液,则c中溶液先变红后褪色
B. 若a为浓硫酸,b为木炭,c中盛有苯酚钠溶液,则c中出现白色浑浊
C. 若a为浓氨水,b为生石灰,c中盛A1C13溶液,则c中产生白色沉淀且沉淀不溶解
D. 若a为稀盐酸,b为大理石,c中盛有BaCl2溶液,则c中溶液不变浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com