
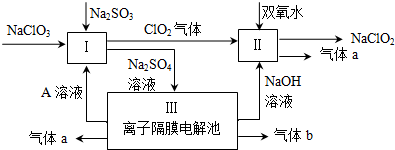
分析 硫酸钠溶液通入离子隔膜电解池中,ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2 ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;
III中发生电解,根据图知,生成氢氧化钠,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,I中NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O;
(1)同一化学反应中,失电子化合价降低的反应物是还原剂;
(2)碱性条件下,ClO2、H2O2发生氧化还原反应生成氧气、ClO2-和水;
(3)①根据在反应物中,化合价降低的物质是氧化剂,化合价升高的物质是还原剂来分析解答;
②根据题干信息“研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大”结合①方程式进行分析解答.
解答 解:硫酸钠溶液通入离子隔膜电解池中,ClO2和双氧水在II中发生氧化还原反应生成NaClO2和气体a,该反应中Cl元素化合价由+4价变为+3价,则O元素化合价由-1价变为0价,所以生成的气体a是O2,离子反应方程式为2 ClO2+H2O2+2OH-=2 ClO2-+O2↑+2H2O;
III中发生电解,根据图知,生成氢氧化钠,阴极上生成氢气同时阴极附近生成NaOH,所以生成的气体b是H2;阳极上氢氧根离子放电生成氧气,所以a是O2,同时生成硫酸,所以A溶液是硫酸;酸性条件下,I中NaClO2、Na2SO3发生氧化还原反应,离子反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O;
(1)同一化学反应中,失电子化合价降低的反应物是还原剂,
I中反应方程式为2ClO3-+2H++SO32-=2ClO2↑+SO42-+H2O,还原剂是Na2SO3;III中氧化剂和还原剂都是水,
故答案为:Na2SO3;H2O;
(2)碱性条件下,ClO2、H2O2发生氧化还原反应生成氧气、ClO2-和水,离子方程式为2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O,
故答案为:2ClO2+H2O2+2OH-=2ClO2-+O2↑+2H2O;
(3)①5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,4NaClO2→4ClO2,+3价的氯元素化合价升高到+4价,所以NaClO2是还原剂;1NaClO2→1NaCl,+3价的氯元素的化合价降低到-1价,所以部分NaClO2作氧化剂;所以该反应中氧化剂和还原剂的物质的量之比为1:4,
故答案为:1:4;
②5NaClO2+4HCl=5NaCl+4ClO2↑+2H2O反应中,ClO2-具有氧化性,ClO2-的氧化性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2,根据研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,
故答案为:ClO2-的氧化性或Cl-的还原性随溶液的酸性和浓度的增大而增强,因此Cl-被氧化得到Cl2.
点评 本题考查生产NaClO2的制备实验的工业设计,把握物质的性质熟练运用氧化还原反应为解答该题的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大 | |
| D. | 镀锌铁比较耐用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
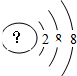 某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
某同学在画某种元素的一种单核微粒的结构示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 77 | B. | 95 | C. | 172 | D. | 249 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ds原子在周期表中位于第7周期第Ⅷ族 | |
| B. | Ds是IB元素 | |
| C. | Ds元素为放射性元素 | |
| D. | Ds元素在元素周期表中d区 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 1 mol NH4CI 固体中共价键总数为5NA | |
| B. | 16g O2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1 mol N2,充分反应后得2NA 个氨分子 | |
| D. | 18g水(H2O)含有8NA个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com