
【题目】工业上用合成气(CO和H2)制取乙醇的反应为2CO+4H2![]() CH3CH2OH+H2O;以CO、O2、NH3为原料,可合成尿素[CO(NH2)2]。下列叙述错误的是
CH3CH2OH+H2O;以CO、O2、NH3为原料,可合成尿素[CO(NH2)2]。下列叙述错误的是
A.H2O分子VSEPR模型为V形
B.CH3CH2OH分子中亚甲基(-CH2-)上的C原子的杂化形式为sp3
C.在上述涉及的4种物质中,沸点从低到高的顺序为H2<CO< H2O<CH3CH2OH
D.CO(NH2)2分子中含有的σ键与π键的数目之比为7:1
【答案】AC
【解析】
A. 水分子中价层电子对数为2+![]() =4,所以VSEPR模型为正四面体结构,A错误;
=4,所以VSEPR模型为正四面体结构,A错误;
B. CH3CH2OH分子中亚甲基(-CH2-)上的C原子形成了4个σ键,没有孤电子对,杂化轨道数目为4,所以C原子的杂化形式为sp3杂化,B正确;
C. 四种物质都是由分子构成的分子晶体,分子之间通过分子间作用力结合,在室温下H2和CO是气体,H2O和CH3CH2OH是液体,气体的沸点小于液体物质的沸点,分子间作用力H2<CO,所以物质的沸点H2<CO;H2O和CH3CH2OH分子之间都存在分子间作用力,而且分子间还存在氢键,由于氢键:H2O>CH3CH2OH,所以物质的沸点CH3CH2OH<H2O,故四种物质的沸点从低到高的顺序为H2<CO<CH3CH2OH<H2O,C错误;
D. CO(NH2)2分子中含有的σ键数目为7个,含有π键的数目是1个,所以分子中含有的σ键与π键的数目之比为7:1,D正确;
故答案选AC。


科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的数值,下列说法不正确的是( )
A.电解精炼铜时,若阳极质量减少64 g,则转移到阴极的电子数不一定等于2NA
B.18 g氨基(-ND2)中含有的电子数为10NA
C.用惰性电极电解100 mL 0.1 mol·L-1的CuSO4溶液,当阴、阳两极产生相同条件下等体积的气体时,电路中转移电子数为0. 04NA
D.工业合成氨每断裂NA个N≡N键,同时断裂6NA个N-H键,则反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物(ZXY)2的结构式如图所示。下列说法错误的是
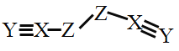
A.化合物WY是良好的耐热冲击材料
B.Y的氧化物对应的水化物可能是弱酸
C.X的氢化物的沸点一定小于Z的
D.化合物(ZXY)2中所有原子均满足8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现Pd2团簇可催化CO的氧化,在催化过程中路径不同可能生成不同的过渡态和中间产物(过渡态已标出),下图为路径1和路径2催化的能量变化。下列说法错误的是

A.CO的催化氧化反应为2CO+O2=2CO2
B.反应路径1的催化效果更好
C.路径1和路径2第一步能量变化都为3.22 eV
D.路径 1 中最大能垒(活化能)E正 =1.77 eV
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铜阳极泥(主要成分是Cu2Te,含Ag、Au等杂质)为原料提取碲并回收金属,其工艺流程如下:
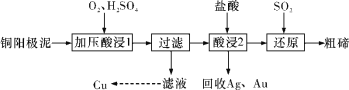
已知:TeO2是两性氧化物,微溶于水,易溶于较浓的强酸和强碱。下列说法错误的是
A.“加压酸浸1”过程中将碲元素转化成TeO2,应严格控制溶液的pH值
B.“酸浸2”过程中温度不能过高,否则会使碲的浸出率降低
C.从Ag和Au中分离出Au,应该向回收的Ag和Au中加入稀氨水
D.“还原”反应中发生的离子方程式为:TeO2+2SO2+2H2O=Te+2SO42-+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在科技进步方面发挥着重要的作用。下列说法正确的是
A. 是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
是制备有机发光二极管OLED的材料之一,其属于有机高分子化合物
B.2019世界能源大会把核能作为含碳能源重要替代品,核电站把化学能转化为电能
C.DAC法能够实现直接从空气中捕获二氧化碳,该法可缓解全球日益严重的温室效应
D.以纯净物聚丙烯为原料生产的熔喷布口罩,在“新冠肺炎战疫”中发挥了重要作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒容的条件下对于N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1∶3∶2的状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,装置(I)是一种可充电电池,装置(Ⅱ)为惰性电极的电解池。下列说法正确的是

A. 闭合开关K时,电极B为负极,且电极反应式为:2Brˉ-2eˉ=Br2
B. 装置(I)放电时,总反应为:2Na2S2+Br2=Na2S4+2NaBr
C. 装置(I)充电时,Na+从左到右通过阳离子交换膜
D. 该装置电路中有0.1moleˉ通过时,电极Ⅹ上析出3.2gCu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 X、Y、Z、W 原子序数依次增大,Y 与 W 同族。X、Y、Z 三种原子最外层电子数的关系 为 X+Z=Y。电解 Z 与 W 形成的化合物的水溶液,产生 W 元素的气体单质,此气体同冷烧碱溶液作 用,可得到化合物 ZWX 的溶液。下列说法正确的是
A.W 的氢化物稳定性强于 Y 的氢化物
B.Z与其他三种元素分别形成的化合物中只含有离子键
C.Z 与 Y 形成的化合物的水溶液呈碱性
D.对应的简单离子半径大小为 W >Z > X>Y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com