
下列各项说法不是Fe(OH)3胶体特有的性质的是( )
A.Fe(OH)3胶体粒子所作的布朗运动
B 在电场作用下,Fe(OH)3胶体粒子在分散剂里作定向移动
C.当光束通过Fe(OH)3胶体时,可以看到一条光亮的“通路”
D.向Fe(OH)3胶体中逐滴加入盐酸时会观察到先变浑浊再变澄清。
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:
下列实验装置用途正确的是
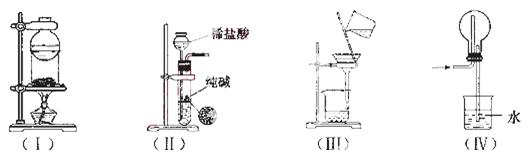
A.装置(I)用于I2与NH4Cl混合物的分离
B. 装置(Ⅱ)用于制取少量纯净的CO2气体
C.装置(III)用于去除Fe(0H)3胶体中含有的可溶性物质
D.装置(Ⅳ)用于HC1的吸收,以防倒吸
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.信息产业中的光缆的主要成份是单质硅
B.NOx、CO2、PM2.5颗粒都会导致酸雨
C.煤经气化、液化和干馏三个物理变化过程,可变为清洁能源
D.高铁车厢大部分材料采用铝合金,因铝合金强度大、质量轻、抗腐蚀能力强
查看答案和解析>>
科目:高中化学 来源: 题型:
通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中
Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.0010 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:
2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00 mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5 mol·L-1,应保持溶液中c(C2O42-)≥ ▲ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为 ▲ 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 ▲(填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量(写出计算过程)。
▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在粗盐提纯的实验中,蒸发时正确的操作是:
A.把浑浊的液体倒入蒸发皿内加热 B.开始析出晶体后用玻璃棒搅拌
C.待水分完全蒸干后停止加热 D.蒸发皿中出现大量固体时即停止加热
查看答案和解析>>
科目:高中化学 来源: 题型:
0.5L 1mol/L的FeCl3溶液与0.2L 1 mol/L的KCl溶液中,Cl-的物质的量浓度之比为( )
A.15∶2 B.1∶1 C.3∶1 D.1∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需用240mL 1mol/L的氢氧化钠溶液。填空并请回答下列问题:
(1) 配制所需体积的 1mol/L的氢氧化钠溶液
| 应称取氢氧化钠固体的质量/g | 应选用容量瓶的规格/mL | 除烧杯、托盘天平、容量瓶、量筒外还需的其它仪器 |
(2)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次) ;
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用托盘天平准确称取所需的氢氧化钠固体,倒入烧杯中,再加入少量水(约30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将已冷却的溶液沿玻璃棒注入一定规格的容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)操作A中,将洗涤液都移入容量瓶,其目的是 ,溶液注入容量瓶前需恢复到室温,这是因为
;
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线___________________。
(5)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度 ;
向容量瓶中转移溶液时(实验步骤②)不慎有液滴掉在容量瓶外面
。
查看答案和解析>>
科目:高中化学 来源: 题型:
无水AlCl3可用作有机合成的催化剂,食品膨松剂等。已知AlCl3、FeCl3分别在183℃、315℃时升华,无水AlCl3遇潮湿空气即产生大量白雾。
I.工业上由铝土矿(主要成分是Al2O3和Fe2O3)和石油焦(主要成分是碳单质)制备无水AlCl3的流程如下:
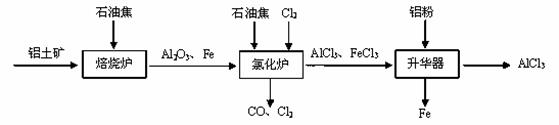
(1)焙烧炉中发生反应:①Fe2O3(s) +3C(s)  2Fe(s) +3CO(g);
2Fe(s) +3CO(g);
②3CO(g)+Fe2O3(s)  2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
则反应②的平衡常数的表达式为K= ▲ 。
(2)氯化炉中Al2O3、Cl2和C在高温下发生反应的化学方程式为 ▲ ;炉气中含有大量CO和少量Cl2,可用Na2SO3溶液除去Cl2,其离子方程式为 ▲ 。
(3)精制无水AlCl3的合格品中,AlCl3的质量分数不得低于96%。现称取16.25 g精制后的无水AlCl3样品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,其残留固体质量为0.16g。该样品中AlCl3的质量分数为 ▲ 。
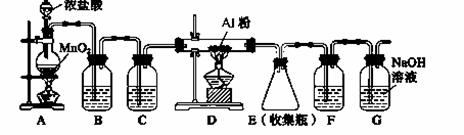
II.实验室可用下列装置制备无水AlCl3。装置B、C中应盛放的试剂名称分别为 ▲ 、
▲ ,F中所盛放试剂的作用是 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
A.v(W)=3v(Z) B.2v(X)=3v(Z)
C.2v(X)=v(Y) D.3v(W)=2v(X)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com