
通过血液中的钙离子的检测能够帮助判断多种疾病。某研究小组为测定血液样品中
Ca2+的含量(100 mL血液中含Ca2+的质量),实验步骤如下:
①准确量取5.00 mL血液样品,处理后配制成50.00 mL溶液;
②准确量取溶液10.00 mL,加入过量(NH4)2C2O4溶液,使Ca2+完全转化成CaC2O4沉淀;
③过滤并洗净所得CaC2O4沉淀,用过量稀硫酸溶解,生成H2C2O4和CaSO4稀溶液;
④加入12.00 mL 0.0010 mol·L-1的KMnO4溶液,使H2C2O4完全被氧化,离子方程式为:
2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
⑤用0.0020 mol·L-1 (NH4)2Fe(SO4)2溶液滴定过量的KMnO4溶液,消耗(NH4)2Fe(SO4)2溶液20.00 mL。
(1)已知室温下CaC2O4的Ksp=2.0×10-9,欲使步骤②中c(Ca2+)≤1.0×10-5 mol·L-1,应保持溶液中c(C2O42-)≥ ▲ mol·L-1。
(2)步骤⑤中有Mn2+生成,发生反应的离子方程式为 ▲ 。
(3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,测得血液中Ca2+的含量将 ▲(填“偏高”、“偏低”或“不变”)。
(4)计算血样中Ca2+的含量(写出计算过程)。
▲ 。
【知识点】滴定问题、化学计算、
【答案解析】(1)2.0×104(2)MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O(3)偏低(4)100mL血样中Ca2+的含量为:0.04g
解析:(1)因为CaC2O4 Ca2++ C2O42- CaC2O4的Ksp=c(Ca2+).c(C2O42-) 溶液中c(C2O42-)≥ 2.0×10-9 /1.0×10-5=2.0×104;(2)MnO4-与Fe2+发生氧化还原反应,反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O; (3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,标准溶液就会被稀释,导致测得的过量的KMnO4物质的量偏大,而与H2C2O4反应的KMnO4物质的量偏小,因此计算得到血液中Ca2+的含量将偏低。
Ca2++ C2O42- CaC2O4的Ksp=c(Ca2+).c(C2O42-) 溶液中c(C2O42-)≥ 2.0×10-9 /1.0×10-5=2.0×104;(2)MnO4-与Fe2+发生氧化还原反应,反应的离子方程式为:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O; (3)若步骤⑤滴定管在使用前未用标准(NH4)2Fe(SO4)2溶液洗涤,标准溶液就会被稀释,导致测得的过量的KMnO4物质的量偏大,而与H2C2O4反应的KMnO4物质的量偏小,因此计算得到血液中Ca2+的含量将偏低。
KMnO4总物质的量为:0.0010×12×103=1.2×105mol
(NH4)2Fe(SO4)2溶液滴定消耗的过量的KMnO4物质的量为:0.0020×20.00×103×1/5=8.0×106mol;
与H2C2O4反应的KMnO4物质的量为:1.2×105mol-8.0×106mol=4.0×106mol
n(H2C2O4)=4.0×106mol×5/2=1.0×105mol;
n(CaC2O4)=1.0×105mol;
100mL血样中Ca2+的含量为:1.0×105mol×40g/mol×50mL/10mL×100mL/5mL=0.04g
【思路点拨】本题考查定量分析问题,涉及化学计算、误差分析、离子方程式书写,关键是理解测定血液样品中Ca2+的含量的实验步骤。


科目:高中化学 来源: 题型:
肼(H2N-NH2)和偏二甲肼 [ H2N-N(CH3)2 ] 均可用作火箭燃料。查阅资料得知,肼是一种良好的极性溶剂,沿肼分子球棍模型的氮、氮键方向观察,看到的平面图如下图所示。
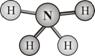 下列说法不正确的是
下列说法不正确的是
A.肼分子中的氮原子采用sp3杂化
B.肼分子中既有极性键又有非极性键
C.肼分子是非极性分子
D.肼与偏二甲肼互称同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
气体的体积主要由以下什么因素决定的:①气体分子的直径 ②气体物质的量的多少③气体分子间的平均距离 ④气体分子的相对分子质量
A.①② B.①③ C.②③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
甲、乙、丙、丁、戊的相互转化关系如图所示(反应条件略去,箭头表示一步转化)。下列各组物质中,不满足图示转化关系的是
| 甲 | 乙 | 丙 | 戊 | |
| ① | NH3 | O2 | NO | H2O |
| ② | Fe | H2O | H2 | Fe2O3 |
| ③ | Al2O3 | NaOH溶液 | NaAlO2溶液 | 过量CO2 |
| ④ | Na2O2 | CO2 | O2 | Na |
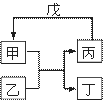
A.①③ B.②③ C.②④ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列根据实验操作和现象所得出的结论正确的是
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用铂丝蘸取少量某无色溶液进行焰色反应 | 火焰呈黄色 | 该溶液一定是钠盐溶液 |
| B | 向浓度均为0.1mol·L-1 NaCl 和NaI 混合溶液中滴加少量AgNO3 溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 向溶液X 中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X 中一定含有SO42- |
| D | 向淀粉水解液中加入新制Cu(OH)2,煮沸 | 没有生成砖红色沉淀 | 淀粉未水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
从加热氯酸钾与MnO2的混合物制氧气后的剩余物中回收二氧化锰的操作顺序正确的是( )
A.溶解、过滤、蒸发、洗涤 B.溶解、过滤、洗涤、烘干
C.溶解、蒸发、洗涤、过滤 D.溶解、洗涤、过滤、烘干
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项说法不是Fe(OH)3胶体特有的性质的是( )
A.Fe(OH)3胶体粒子所作的布朗运动
B 在电场作用下,Fe(OH)3胶体粒子在分散剂里作定向移动
C.当光束通过Fe(OH)3胶体时,可以看到一条光亮的“通路”
D.向Fe(OH)3胶体中逐滴加入盐酸时会观察到先变浑浊再变澄清。
查看答案和解析>>
科目:高中化学 来源: 题型:
用下列实验装置或操作进行相应实验,能达到实验目的的是
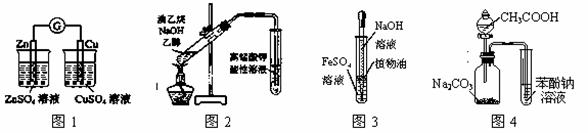
A.用图1装置验证化学能转化为电能
B.用图2所示装置检验溴乙烷与NaOH醇溶液共热产生的乙烯
C.用图3装置制备氢氧化亚铁
D.利用图4装置证明酸性:CH3COOH>H2CO3>苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示的装置的中,观察到电流计指正偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
|
| M | N | P |
| A | Zn | Cu | 稀硫酸溶液 |
| B | Cu | Fe | 稀盐酸 |
| C | Ag | Zn | 硝酸银溶液 |
| D | Zn | Fe | 硫酸亚铁溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com