
【题目】(1)3.6g H2O的物质的量是________,含有________个H2O,含有________molH。
(2)0.1molAl2(SO4)3中含有Al3+________mol、SO42- ________个。
(3)2 mol O3和3mol O2的质量之比为__________。
(4)9.5gMgCl2固体溶于水配成500mL溶液,浓度为______molL1,从中取出100mL溶液,其中Cl的浓度为_____molL1;再把取出的溶液加水稀释成500mL,则此时MgCl2溶液的浓度为______molL1。
【答案】0.2mol 1.204×1023 0.4mol 0.2 1.806×1023 1:1 0.2 0.4 0.04
【解析】
(1)根据n=![]() 、N=nNA进行计算;
、N=nNA进行计算;
(2)由化学式Al2(SO4)3可知,n(Al3+)=2n[Al2(SO4)3],n(SO42-)=3n[Al2(SO4)3],在根据m=nM计算硫酸根的数目;
(3)氧气和臭氧都是氧原子构成的不同单质;
(4)根据c=![]() 进行计算。
进行计算。
(1)水的相对分子质量是18,所以.3.6g H2O的物质的量是![]() =0.2mol;
=0.2mol;
根据N=nNA可知,水分子数是0.2NA=1.204×1023;
1个水分子含有2个氢原子,所以含有0.2mol×2=0.4molH原子;
(2)由化学式Al2(SO4)3可知,n(Al3+)=2n[Al2(SO4)3]=0.1mol×2=0.2mol;
n(SO42-)=3n[Al2(SO4)3]=0.1mol×3=0.3mol,为0.3mol×6.02×1023/mol=1.806×1023个;
(3)氧气和臭氧都是氧原子构成的不同单质,所以2 mol O3和3 mol O2的质量之比1 : 1;
(4)9.5g氯化镁的物质的量为![]() =0.1mol,浓度为
=0.1mol,浓度为![]() =0.2mol/L,从中取出100mL溶液,氯离子浓度不变,氯离子浓度为0.4mol/L,加水稀释后,氯化镁的浓度为
=0.2mol/L,从中取出100mL溶液,氯离子浓度不变,氯离子浓度为0.4mol/L,加水稀释后,氯化镁的浓度为![]() =0.04mol/L。
=0.04mol/L。


科目:高中化学 来源: 题型:
【题目】图所示是组成人体细胞的主要元素及其比例,下列叙述错误的是

A.图中所示为细胞鲜重中元素的比重
B.图中含有的元素在非生物界也可以找到
C.细胞失去大部分水分后,碳元素比例最大
D.因为氧元素含量最多,所以氧是“生命的核心元素”
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1mol·L-1NaOH溶液450mL和0.5mol·L-1硫酸溶液500mL。根据这两种溶液的配制情况回答下列问题:
(1)如图所示的仪器中配制溶液肯定不需要的是__________(填序号),配制上述溶液还需用到的玻璃仪器是__________(填仪器名称)。
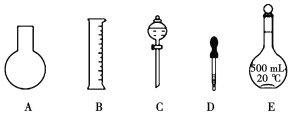
(2)配制0.1mol·L-1NaOH溶液操作步骤如下:
①把称量好的NaOH`固体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液冷却至室温,再小心转入一定容积的容量瓶中;
③继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶瓶塞塞紧,充分摇匀。
操作步骤的正确顺序为__________(填序号)。
(3)根据计算用托盘天平称取NaOH的质量为__________g。在实验中其他操作均正确,若容量瓶用蒸馏水洗涤后未干燥,则所得溶液浓度______________0.10mol·L-1(填“大于”“等于”或“小于”,下同)。若还未等溶液冷却就定容了,则所得溶液浓度__________0.10mol·L-1。
(4)根据计算得知,所需质量分数为98%、密度为1.84g·cm-3的浓硫酸的体积为__________mL(计算结果保留一位小数)。如果实验室有10mL、15mL、20mL、50mL的量筒,应选用__________mL的量筒最好。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为______mol.
(2)该气体所含原子总数为______个.
(3)该气体在标准状况下的体积为______L.
(4)该气体溶于1L水中(不考虑反应),形成的溶液溶质的质量分数为______.
(5)该气体溶于水形成VL溶液,其溶液的物质的量浓度为______mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在3个体积均为1.0L的恒容密闭容器中发生反应2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
2SO3(g) ΔH<0。达到平衡时,下列说法正确的是
容器 | 温度/℃ | 物质的起始浓度/mol·L-1 | 物质的平衡浓度/mol·L-1 | ||
c(SO2) | c(O2) | c(SO3) | c(SO3) | ||
Ⅰ | 758 | 0.2 | 0.1 | 0 | 0.044 |
Ⅱ | 758 | 0.1 | 0.05 | 0 | |
Ⅲ | 858 | 0.2 | 0.1 | 0 | |
A. 从开始至平衡时,容器Ⅰ中SO3的反应速率为0.044 mol·L-1·s-1
B. 平衡时,容器Ⅱ中SO3的浓度小于0.022mol·L-1
C. 平衡时,容器Ⅲ中SO3的浓度大于0.044mol·L-1
D. 若起始时,向容器Ⅰ中充入0.02mol SO2、0.01mol O2和0.02mol SO3,则反应向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莫尔盐[(NH4)2Fe(SO4)26H2O,Mr=392]是一种重要的还原剂,在空气中比一般的亚铁盐稳定。某学习小组设计如下实验制备少量的莫尔盐并测定其纯度。
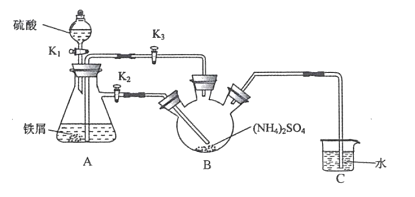
回答下列问题:
Ⅰ制取莫尔盐
(1)连接装置,检査装置气密性。将0.1mol(NH4)2SO4,晶体置于玻璃仪器中______(填仪器名称),将6.0g洁浄铁屑加人锥形瓶中。
(2)①打开分液漏斗瓶塞,关闭活塞K3,打开K2、K1,加完55.0mL2mol·L-1稀硫酸后关闭K1。A装置中反应的离子方程式为____
②待大部分铁粉溶解后,打开K3、关闭K2,此时可以看到的现象为_______,原因是_______
③关闭活塞K2、K3,采用100℃水浴蒸发B中水分,液面产生晶膜时,停止加热,冷却结晶、____、用无水乙醇洗涤晶体。该反应中硫酸需过量,保持溶液的pH在1~2之间,其目的为____
④装置C的作用为 ____,装置C存在的缺点是____
Ⅱ.测定莫尔盐样品的纯度
(3)称取所得莫尔盐样品10.0g,用煮沸后冷却的蒸馏水配成100mL溶液,取20.00mL溶液加人稀硫酸,用0.1molL-1的KMnO4溶液滴定,达到滴定终点时消耗10.00mlKMnO4溶液。滴定反应的离子方程式为____,该样品的纯度为____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 因为二氧化硫具有漂白性,所以它能使品红溶液、溴水、高锰酸钾溶液褪色
B. 100mL0.5mol/LH2O2溶液与足量SO2完全反应,转移的电子数为0.1NA
C. 二氧化硫、Cl2以及活性炭都能使红墨水褪色,其原理不同
D. 等物质的量的二氧化硫和氯气相遇在溶液中具有更强的漂白能力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生需要用烧碱固体配制0.5mol·L-1的NaOH溶液480mL。实验室提供以下仪器:
①100mL烧杯 ②100mL量筒 ③1000mL容量瓶 ④500mL容量瓶 ⑤玻璃棒 ⑥托盘天平(带砝码) ⑦药匙。请回答下列问题:
(1)计算需要称取NaOH固体_________g。
(2)配制时,必须使用的仪器有_______(填代号),还缺了仪器名称是_________。
(3)配制时,其正确的操作顺序是(字母表示,每个操作只用一次)________。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
(4)若出现如下情况,其中将引起所配溶液浓度偏高的是___。(填下列编号)
①容量瓶实验前用蒸馏水洗干净,但未烘干 ②定容观察液面时俯视
③配制过程中遗漏了(3)中步骤A ④加蒸馏水时不慎超过了刻度
⑤未等NaOH溶液冷却至室温就转移到容量瓶中
(5)用配制好的溶液,再来配制50ml0.2mol·Lˉ1的NaOH溶液,需要取原配好的溶液_____ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z三种元素,已知:①X、Y、Z的单质在常温下均为气体;②X单质可在Z单质中燃烧,生成XZ,火焰为苍白色;③XZ极易溶于水,其水溶液可使蓝色石蕊试纸变红;④每2个X2分子可与1个Y2分子化合生成2个X2Y分子,X2Y在常温下为液体;⑤Z单质溶于X2Y中,所得溶液具有漂白作用;⑥细铁丝能在Z2(g)中剧烈燃烧,且产生红棕色烟。推断:
(1)X、Y两种元素的名称X___,Y___。
(2)化合物的化学式:XZ___,X2Y___。
(3)过程⑥中涉及的化学反应方程式为___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com