
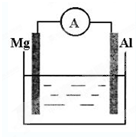
 如图所示,组成一个原电池.
如图所示,组成一个原电池.

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
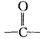 官能团.
官能团.查看答案和解析>>
科目:高中化学 来源: 题型:
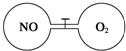 如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)
如图所示,两个连通容器用活塞分开,左右两室(体积相同)各充入一定量NO和O2,且恰好使两容器内气体密度相同.打开活塞,使NO与O2充分反应(2NO+O2=2NO2).(不考虑NO2与N2O4的转化)查看答案和解析>>
科目:高中化学 来源: 题型:
 工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=QkJ/mol
工业上在合成塔中采用下列反应合成甲醇:CO(g)+2H2(g)?CH3OH(g)△H=QkJ/mol| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| 容器 | 甲 | 乙 | 丙 | |
| 反应物投入量 | 1mol CO 2mol H2 | 1mol CH3OH | 2mol CH3OH | |
| 平 衡 时 数 据 | CH3OH的浓度(mol?L-1) | c1 | c2 | c3 |
| 反应吸收或放出的能量(KJ) | a | b | c | |
| 体系压强(Pa) | P1 | P2 | P3 | |
| 反应物转化率 | α1 | α2 | α3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 操作 | 现象 | 结论 |
| A | 在蔗糖中加入几滴水搅拌均匀,再加入浓硫酸,迅速搅拌 | 蔗糖逐渐变黑,体积膨胀,形成疏松多孔的物质 | 只体现了浓硫酸的脱水性 |
| B | 淀粉和稀硫酸混合共热后,再加少量新制氢氧化铜悬浊液 | 产生红色沉淀 | 淀粉水解可生成葡萄糖 |
| C | 溴乙烷和氢氧化钠溶液充分反应后,用足量稀硝酸酸化,再加入硝酸银溶液 | 生成淡黄色沉淀 | 溴乙烷中含有溴元素 |
| D | 将溴水加入苯中并充分振荡 | 溴水褪色 | 苯与溴发生了取代反应 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com