
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程: 。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g)△H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2-,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10-16,K稳Ag(CN)2-]=1.0×1021,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]() N2O4其相关图像如下。
N2O4其相关图像如下。
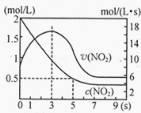
①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
【答案】(1)![]() (1分)
(1分)
(2)N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=-631.7kJ/mol (2分)
(3)AgI(s)+2CN—(aq)![]() Ag(CN)2—(aq)+I—(aq)(2分) 1.5×105(2分)
Ag(CN)2—(aq)+I—(aq)(2分) 1.5×105(2分)
(4)NH3—5e—+5OH—=NO+4H2O(2分)
(5)容器为绝热体系,该反应正向进行放热,体系温度升高,v(NO2)增大(1分); 75%
【解析】
试题分析:(1)氮气是含有氮氮三键的单质,用电子式表示氮气的形成过程为![]() ;
;
(2)△H等于反应物的键能之和-生成物的键能之和,N2H4 (g)燃烧热的热化学方程式为N2H4 (g)+O2(g)=N2(g)+2H2O(l) △H=(390.8×4+193+497.3)-(946+462.8×4)-44×2=—631.7kJ/mol;
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为AgI(s)+2CN-(aq)![]() Ag(CN)2-(aq)+I-(aq);则上述转化方程式的平衡常数K=
Ag(CN)2-(aq)+I-(aq);则上述转化方程式的平衡常数K=![]() =
=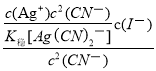 =
= =1.5×105;
=1.5×105;
(4)氨的催化氧化的方程式为4NH3+5O2═4NO+6H2O,该反应设计成新型电池,在碱性环境下,该电池的负极上氨气失去电子生成一氧化氮气体,电极反应式为NH3—5e-+5OH-=NO+4H2O;
(5)①依据反应是放热反应,在绝热恒容容器中,反应放热,温度升高,反应速率增大,随反应进行二氧化氮浓度减小,反应未达到平衡,0~3s时v(NO2)增大是由于体系温度升高。
②分析图象5s二氧化氮变化浓度=2mol/L-0.5mol/L=1.5mol/L,因此5s时NO2转化率为=![]() ×100%=75%。
×100%=75%。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)是一种重要的氧化剂,可以检验司机是否酒后驾驶。Cr2O72-+3C2H5OH+16H+=4[Cr(H2O)6]3++3CH3COOH
(1)铬原子核外有______个未成对电子。1mol[Cr(H2O)6]3+中含有δ键的数目是______。
(2)CH3COOH中C原子轨道杂化类型为_________。
(3)CH3CH2OH与H2O可以任意比互溶,是因为_________。
(4)C、O位于周期表中第二周期,请比较两者第一电离大小:C_____O(填“>”或“<”)
(5)Cr和Ca可以形成一种具有特殊导电性的复合氧化物,晶胞如图所示。该晶体的化学式为__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2升的密闭容器中,发生以下反应:2A(g)+B(g)![]() 2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
2C(g)+D(g)。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速率为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,容器内某一反应中M、N的物质的量随反应时间的变化曲线如图,下列表述中正确的是( )
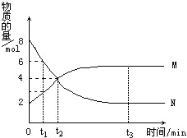
A、反应的化学方程式为:2M![]() N
N
B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率
D.t1时,N的浓度是M浓度的2倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学化学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下:
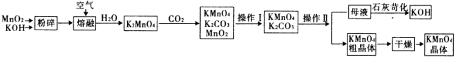
(1)铋酸钠(NaBiO3,不溶于水)用于定性检验酸性溶液中Mn2+的存在(铋的还原产物为Bi3+),Mn2+的氧化产物为MnO4-,写出反应的离子方程式_________________________________________。
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是_____(填代号)。
a.84消毒液(NaClO溶液) b.双氧水 c.苯酚 d.75%酒精
(3)上述流程中可以循环使用的物质有氢氧化钾和_______(写化学式)。
(4)理论上(若不考虑物质循环与制备过程中的损失)1 mol MnO2可制得_____mol KMnO4。
(5)该生产中需要纯净的CO2气体。写出实验室制取CO2的化学方程式___________________,所需气体发生装置可以是______(选填代号)。
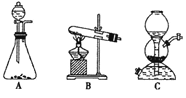
(6)操作Ⅰ的名称是________;操作Ⅱ根据 KMnO4和K2CO3两物质在______(填性质)上的差异,
采用__________(填操作步骤)、趁热过滤得到 KMnO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题

(1)⑤和⑧的元素符号是_______和_______。
(2)表中最活泼的金属元素是___________,形成化合物种类最多的元素是_________(填写元素名称)。
(3)表中能形成两性氢氧化物的元素是___________,分别写出该元素的氢氧化物与⑥、⑨最高价氧化物的水化物反应的化学方程式:__________________;__________________。
(4)证明元素⑥、⑦非金属性强弱,用一个化学方程式表示:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B两种烃,已知A的分子式为C5Hm,而B的最简式为C5Hn(m、n均为正整数).请回答下列问题:
(1)下列关于烃A和烃B的说法不正确的是 (填序号).
a.烃A和烃B可能互为同系物
b.烃A和烃B可能互为同分异构体
c.当m=12时,烃A一定为烷烃
d.当n=11时,烃B可能的分子式有2种
(2)若烃A为链烃,且分子中所有碳原子一定共面,在一定条件下,1mol A最多可与1mol H2加成,则A的名称是 .
(3)若烃B为苯的同系物,取一定量的烃B完全燃烧后,生成物先通过足量的浓硫酸,浓硫酸的质量增加1.26g,再通过足量的碱石灰,碱石灰的质量增加4.4g,则烃B的分子式为 ;若其苯环上的一溴代物只有一种,则符合此条件的烃B有 种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药狼把草全草浸剂给动物注射,有镇静、降压及轻度增大心跳振幅的作用。有机物M是中药狼把草的成分之一,其结构如图所示。下列叙述不正确的是( )
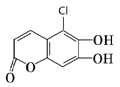
A. M是芳香族化合物,它的分子式为C9H5O4Cl
B. 1 mol M最多能与含2 mol Br2的溴水发生反应
C. 1 mol M分别与足量的NaOH溶液、Na2CO3溶液反应,消耗两种物质的物质的量分别为4 mol、2mol
D. 在一定条件下能发生取代、加成、水解、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋是一个巨大的物质资源和能量宝库,世界各国都在研究如何充分利用海洋资源。
Ⅰ. 从海水中可以提取食盐。
Ⅱ.从海水中提取镁。已知MgO、MgCl2的熔点分别为2800℃、604℃,从海水中提
取镁,最合理的方法是 。
A.海水![]() Mg(OH)2
Mg(OH)2![]() Mg
Mg
B.海水![]() MgCl2溶液→MgCl2熔融
MgCl2溶液→MgCl2熔融![]() Mg
Mg
C.海水![]() Mg(OH)2
Mg(OH)2![]() MgO
MgO![]() Mg
Mg
D.海水![]() Mg(OH)2
Mg(OH)2![]() MgCl2溶液→MgCl2熔融
MgCl2溶液→MgCl2熔融![]() Mg
Mg
Ⅲ.从海水中提溴。其工业方法有:空气吹出纯碱吸收法、空气吹出SO2吸收法、溶
剂萃取法等。
(1)空气吹出纯碱吸收法。将氯气通入富含溴离子的海水中,再用空气将溴吹出,
用纯碱溶液吸收,最后用硫酸酸化,即可得到溴单质.该方法涉及的反应有:
① (写出离子方程式);
②3Br2+3CO32﹣═BrO3﹣+5Br﹣+3CO2↑;
③BrO3﹣+5Br﹣+6H+═3Br2+3H2O
(2)空气吹出SO2吸收法。该方法基本同(1),只是将溴吹出后是用SO2来吸收的,
然后再用氯气氧化即得单质溴。
写出溴与二氧化硫反应的化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com