
����Ŀ��A��B��C��D��E���Ƕ�����Ԫ�أ�ԭ�Ӱ뾶D��C��A��E��B������A��B����ͬһ���ڣ�A��C����ͬһ���壮Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ�Cԭ��������ϵĵ�������Dԭ��������������4������DΪ�������Իش�
��1��C��Ԫ������Ϊ ��
��2��������Ԫ���У����γɵ����Һ̬����̬�⻯����ȶ����ɴ�С��˳����
��3��A��B�γɵ���ԭ�ӷ��ӵĽṹʽ�� �� B��D�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ĵ���ʽ�� ��
��4����д��һ��������5��Ԫ���в���Ԫ���γɵ����ʣ������û���Ӧ����ʽ ��
���𰸡�
��1����
��2��H2O��NH3
��3��O=C=O��![]()
��4��2C+SiO2 ![]() 2CO��+Si
2CO��+Si
���������⣺A��B��C��D���Ƕ�����Ԫ�أ�ԭ�Ӱ뾶D��C��A��B������A��B����ͬһ���ڣ�A��C����ͬһ���壬����Ԫ�������ڱ��еĴ������λ��Ϊ�� ![]() ��A��C����ͬһ���壬�������������8��Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ���B��������Ϊ8����BΪOԪ�أ�Cԭ��������ϵĵ�������Dԭ��������������4������C����������Ϊ4��D������������Ϊ1����AΪCԪ�أ�CΪSiԪ�أ�DΪNaԪ�أ�E��ԭ�Ӱ뾶����B��O����С��A��̼������EΪNԪ��.
��A��C����ͬһ���壬�������������8��Cԭ�Ӻ�������������A��Bԭ�Ӻ���������֮�ͣ���B��������Ϊ8����BΪOԪ�أ�Cԭ��������ϵĵ�������Dԭ��������������4������C����������Ϊ4��D������������Ϊ1����AΪCԪ�أ�CΪSiԪ�أ�DΪNaԪ�أ�E��ԭ�Ӱ뾶����B��O����С��A��̼������EΪNԪ��.
��1.��CΪSiԪ�أ����Դ��ǣ��裻
��2.���ǽ�����O��N��C��Si�����⻯����ȶ���ΪH2O��NH3��CH4��SiH4 �� ���Դ��ǣ�H2O��NH3��CH4��SiH4��
��3.��A��B�γɵ���ԭ�ӷ���ΪCO2 �� ��ṹʽΪO=C=O��B��D�γɵ�ԭ�Ӹ�����Ϊ1��1�Ļ�����ΪNa2O2 �� ����ʽ�� ![]() �����Դ��ǣ�O=C=O��
�����Դ��ǣ�O=C=O�� ![]() ��
��
��4.��������Ϣ����д����Ӧ2C+SiO2 ![]() 2CO��+Si�����Դ��ǣ�2C+SiO2
2CO��+Si�����Դ��ǣ�2C+SiO2 ![]() 2CO��+Si��
2CO��+Si��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Һ���й��������ʵ���Ũ�ȹ�ϵ��ȷ����
A. ���ʵ���Ũ��֮��Ϊ2��1��NaClO��NaHSO3�����Һ�У�c(HClO)��c(ClO��)��2c(HSO)��2c(H2SO3)��2c(SO![]() )
)
B. ���ʵ���Ũ����ȵĢ� NH4HSO4��Һ���� NH4HCO3��Һ���� NH4Cl��Һ�У�pH�Ĵ�С��ϵ����>��>��
C. �����£�pH��6��NaHSO3��Һ�У�c(SO![]() )��c(H2SO3)��9��10��7 mol��L��1
)��c(H2SO3)��9��10��7 mol��L��1
D. �����£���CH3COONa��Һ��ϡ����������ҺpH��7��c(Na��)>c(CH3COO��)>c(Cl��)��c(CH3COOH)>c(H��)��c(OH��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���5L ���ܱ������г���2molX�����1molY���巢����Ӧ��2X(g)+ Y(g) ![]() 2Z(g)����H��0 ��10min ���ƽ�⣬���������ѹǿ�Ƿ�Ӧǰ��5/6������˵������������
2Z(g)����H��0 ��10min ���ƽ�⣬���������ѹǿ�Ƿ�Ӧǰ��5/6������˵������������
A. ƽ��ʱ��X ��ת����Ϊ50��
B. ���¶���ƽ�ⳣ��K=10
C. 10min��������Z �ķ�Ӧ����0.2mol��L-1 ��min-1
D. ijһʱ�̣�X��Y��Z�����ʵ����ֱ���0.4mol��0.2mol��1.6mol���˿�V��<V��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�سィ�еġ���̬ũҵ�Ƽ�������������ũҵ���¼���ʾ�����ƹ���أ�Ҳ����һ���۹����е���̬ũҵ������һЩ����˼·������Ϊ��������( )
A.��ũ�ҷ��뻯���ۺ�ʹ�ã����������Ч��
B.�Դ����е�ֲ��ʩ��������CO2 �� �Դٽ���������
C.��ֲ����ֳ�����������ϣ��ȿɸ��ƻ����ֿ����ũ����ҵ�IJ���
D.������狀���ʯ�һ��ʹ�ã��ڸ������ṩӪ��Ԫ�ص�ͬʱ�����ܽ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ζ�ʵ���ڻ�ѧ����������ҪӦ�ã�����Ũ��Ϊ0.1000molL-1����KMnO4����Һ�ζ�δ֪Ũ�ȵIJ��ᣨH2C2O4����
��1��д���ζ������з�����Ӧ�����ӷ���ʽΪ _____________________________________ ��
��2���ζ������в����ζ��ܵ�ͼʾ��ȷ���� _______________ ��
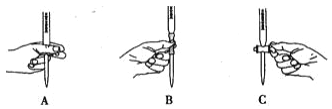
��3�����ζ�ʱ�ζ��ܼ��첿�������ݣ��ζ���������ʧ�������²�õĽ��_____��ѡ���ƫ��������ƫС����������������
��4���õζ�ʵ��ζ��յ��������_____________________________________ ��
��5��Na2Cr2O7�����ڲⶨ��ˮ�Ļ�ѧ����������COD��ָÿ��ˮ���л�ԭ�����ʱ���������ҪO2��������������ijˮ��100.00 mL���ữ�����C1 mol/L��Na2Cr2O7��Һ V1 mL��ʹˮ�еĻ�ԭ��������ȫ��������Cr2O72-��ԭΪCr3+��������C2mol/L��FeSO4��Һ�ζ�ʣ���Cr2O72-���������FeSO4��ҺV2 mL����ȡһ�������Na2Cr2O7��Һʱ����Ҫ��______����ʽ���ʽ���ζ��ܣ���ˮ����CODΪ___________________________mg/L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һϵ�з�Ӧ�����ղ���Ϊ���ᣨ�Ҷ��ᣩ��
B![]() C
C![]() D
D![]() E
E![]() F
F![]()
![]()
��֪BΪijһ����
��1���Ʋ�����ĸ�����Ļ�����Ľṹʽ��C_______________��
��2��E��F�Ļ�ѧ����ʽ��______________________��
��3��д��E�Ͳ�����һ�����������ɸ߷��ӻ�����Ļ�ѧ����ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ���̲ص�Ԫ�ظߴ�80���֣�������Ƹ�����Ҫ��ɢ�أ���ͼ�ǶԺ�ˮ��Դ���ۺ����õ�ʾ��ͼ�� 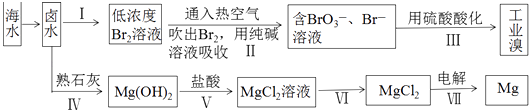
��ش��������⣺
��1��������99%���ϵ���Ԫ�ش����ں����У�������ʾ��ˮ����ĺ���ԼΪ66mgL��1 �� ��ͼ���Ʊ����漰����I��II��III���ֱ�д������II�Ͳ���III�з�Ӧ�����ӷ���ʽ���� ��
��2���Ʊ�þ�Ĺ����У���±ˮ��MgCl2��aq�������� ![]() �Ĺ��̣�����Mg��OH��2�Ĺ��̿��ƶ��࣬��ʵ�ù��̵������� ��
�Ĺ��̣�����Mg��OH��2�Ĺ��̿��ƶ��࣬��ʵ�ù��̵������� ��
��3�������ˮ�Ȼ�þ���õ�þ�������ض��Ļ�������ȴ��Ϊ����þ�����������п�������þ��������ȴ������������ĸ��ţ���
A.Ar
B.CO2
C.O2
D.N2 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ�ó��Ľ��۴������( )
A.ά��������ϳ����أ�ͻ�����������л���Ľ���
B.�Ž��з���ǰ�˹����Ļ������ܽ����Ԫ�������ɣ�������ѧ�о���Ҫ�̳���Ҫ����
C.C60��Ӣ����������ѧ�ҹ�ͬ���ֵģ������˹��ʿƼ���������Ҫ��
D.�ƶ��Ͳ��ն������ۻ�ѧ����Ĺ���ŵ������ѧ������ζ�Ż�ѧ�ѳ�Ϊ�������о�Ϊ����ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У�����������ԭ��Ӧ�����������������
A.K+��H+��I-��MnO4-B.Fe3+��Fe2+��SO42-��NO3-
C.Al3+��Na+��SO42-��CO32-D.Fe3+��H+��SO42-��ClO-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com