
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是
A. 物质的量浓度之比为2∶1的NaClO、NaHSO3混合溶液中:c(HClO)+c(ClO-)=2c(HSO)+2c(H2SO3)+2c(SO![]() )
)
B. 物质的量浓度相等的① NH4HSO4溶液、② NH4HCO3溶液、③ NH4Cl溶液中,pH的大小关系:②>①>③
C. 常温下,pH=6的NaHSO3溶液中:c(SO![]() )-c(H2SO3)=9×10-7 mol·L-1
)-c(H2SO3)=9×10-7 mol·L-1
D. 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-)
【答案】D
【解析】A.NaClO、NaHSO3混合溶液中要发生氧化还原反应,生成氯化钠和硫酸钠,故A错误;B.硫酸氢铵是强酸弱碱酸式盐,硫酸氢根离子电离出氢离子,抑制铵根离子水解,但溶液呈强酸性,碳酸氢铵中HCO3-的水解程度大于NH4+的水解程度,所以NH4HCO3溶液呈碱性,氯化铵水解而使其溶液呈酸性,但小于硫酸氢铵的酸性,所以 pH的大小关系:②>③>①,故B错误;C.常温下,亚硫酸氢钠呈酸性,说明亚硫酸氢根离子的电离程度大于水解程度,根据物料守恒得c(Na+)=c(H2SO3)+c(HSO3-)+c(SO32-)①,根据电荷守恒得c(Na+)+c(H+)= c(OH-)+c(HSO3-)+2c(SO32-)②,将方程式①代入②得,c(H2SO3)+c(H+)= c(OH-)+c(SO32-),所以c(SO32-)-c(H2SO3)=c(H+)-c(OH-)=(10-6-10-8 )mol/L=9.9×10-7molL-1,故C错误;D.溶液pH=7,则c(H+)=c(OH-),氯化氢电离出的氢离子和醋酸根离子结合生成醋酸,所以溶液中c(Cl-)= c(CH3COOH),醋酸根离子水解而钠离子不水解,所以c(Na+)>c(CH3COO-),CH3COONa溶液呈弱碱性,要使溶液呈中性,则向醋酸钠溶液中加入少量盐酸,醋酸钠的量远远大于盐酸的量,所以c(CH3COO-)>c(Cl-),故D正确;故选D。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】将等物质的量的X、Y气体充入某密闭容器中,在一定条件下,发生如下反应并达到平衡:
X(g)+ 3Y(g) ![]() 2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
2Z(g) △H<0 当改变某个条件并维持新条件直至新的平衡时,下表中关于新平衡与原平衡的比较正确的是
选项 | 改变条件 | 新平衡与原平衡比较 |
A | 升高温度 | X的转化率变小 |
B | 增大压强 | X的浓度变小 |
C | 充入一定量Y | Y的转化率增大 |
D | 使用适当催化剂 | X的体积分数变小 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向25mL18.4mol/LH2SO4溶液中加入足量的铜片并加热,充分反应后,被还原的H2SO4的物质的量( )
A.小于0.23mol
B.等于0.23mol
C.0.23mol~0.46mol之间
D.等于0.46mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于油脂的叙述错误的一项是( )
A.从溴水中提取溴可用植物油作萃取剂
B.用热的纯碱溶液去油污效果更好
C.硬水使肥皂去污能力减弱是因为发生了沉淀反应
D.用热的纯碱溶液可区别植物油和矿物油
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学方程式可简明地体现元素及其化合物的性质。已知:氧化还原反应:
2FeCl3+2HI===2FeCl2+I2+2HCl 2Co(OH)3+6HCl===2CoCl2+Cl2↑+6H2O
2Fe(OH)2+I2+2KOH===2Fe(OH)3+2KI 3I2+6KOH===5KI+KIO3+3H2O
复分解反应:
2HSCN+K2CO3===2KSCN+CO2↑+H2O KCN+CO2+H2O===HCN+KHCO3
热分解反应:
4NaClO![]() 3NaCl+NaClO4 NaClO4
3NaCl+NaClO4 NaClO4![]() NaCl+2O2↑
NaCl+2O2↑
下列说法不正确的是
A. 氧化性(酸性溶液):FeCl3>Co(OH)3>I2 B. 还原性(碱性溶液):Fe(OH)2>I2>KIO3
C. 热稳定性:NaCl>NaClO4>NaClO D. 酸性(水溶液):HSCN>H2CO3>HCN
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的根本原因是
A. 元素原子的核外电子排布呈周期性变化
B. 元素的金属性和非金属性呈周期性变化
C. 元素的原子半径呈周期性变化
D. 元素化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( ) 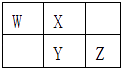
A.X,Y,Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E都是短周期元素,原子半径D>C>A>E>B,其中A、B处在同一周期,A、C处在同一主族.C原子核内质子数等于A、B原子核内质子数之和,C原子最外层上的电子数是D原子最外层电子数的4倍,且D为金属.试回答:
(1)C的元素名称为 .
(2)在五种元素中,能形成的最简单的液态或气态氢化物的稳定性由大到小的顺序是
(3)A与B形成的三原子分子的结构式是 , B与D形成的原子个数比为1:1的化合物的电子式是 .
(4)请写出一个由以上5种元素中部分元素形成的物质,发生置换反应方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com