
【题目】元素性质呈周期性变化的根本原因是
A. 元素原子的核外电子排布呈周期性变化
B. 元素的金属性和非金属性呈周期性变化
C. 元素的原子半径呈周期性变化
D. 元素化合价呈周期性变化
科目:高中化学 来源: 题型:
【题目】对达到平衡状态的可逆反应:A+B![]() C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
C+D,在t1时增大压强,则正、逆反应速率变化如图所示(v表示反应速率,t代表时间),下列有关A、B、C、D的状态叙述正确的是
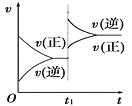
A. A、B、C是气体,D不是气体
B. A、B是气体,C、D有一种是气体
C. C、D是气体,A、B有一种是气体
D. C、D有一种是气体,A、B都不是气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述正确的是( )
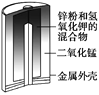
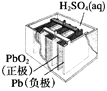
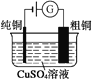
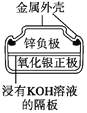
图1 碱性锌锰电池 图2 铅—硫酸蓄电池 图3 电解精炼铜 图4 银锌纽扣电池
A. 图1所示电池中,MnO2的作用是催化剂
B. 图2所示电池放电过程中,硫酸浓度不断增大
C. 图3所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D. 图4所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是
A. 物质的量浓度之比为2∶1的NaClO、NaHSO3混合溶液中:c(HClO)+c(ClO-)=2c(HSO)+2c(H2SO3)+2c(SO![]() )
)
B. 物质的量浓度相等的① NH4HSO4溶液、② NH4HCO3溶液、③ NH4Cl溶液中,pH的大小关系:②>①>③
C. 常温下,pH=6的NaHSO3溶液中:c(SO![]() )-c(H2SO3)=9×10-7 mol·L-1
)-c(H2SO3)=9×10-7 mol·L-1
D. 常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有NaCl、FeCl2、FeCl3、MgCl2、AlCl3、NH4Cl六种溶液,只用一种试剂就可把它们鉴别开来,这种试剂是( )
A. 盐酸 B. 烧碱溶液 C. 氨水 D. KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3 , 如图,已知该分子中 N﹣N﹣N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( ) ![]()
A.分子中 N,O 间形成的共价键是极性键
B.图中加“*”N原子的杂化方式为sp3
C.该物质既有氧化性又有还原性
D.15.2g 该物质含有 6.02×1022个原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解稀H2SO4、CuCl2的混合液,最初一段时间阴极和阳极上分别析出的物质分别是
A.H2和Cl2B.Cu和Cl2C.H2和O2D.Cu和O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在5L 的密闭容器中充入2molX气体和1molY气体发生反应:2X(g)+ Y(g) ![]() 2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是
2Z(g);△H<0 。10min 后达平衡,测得容器内压强是反应前的5/6,下列说法中错误的是
A. 平衡时,X 的转化率为50%
B. 该温度下平衡常数K=10
C. 10min内生成物Z 的反应速率0.2mol·L-1 ·min-1
D. 某一时刻,X、Y、Z的物质的量分别是0.4mol、0.2mol、1.6mol,此刻V正<V逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中蕴藏的元素高达80多种,是人类财富的重要集散地.如图是对海水资源的综合利用的示意图. 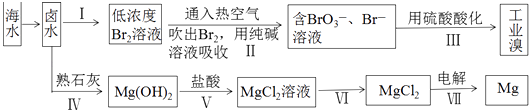
请回答下列问题:
(1)地球上99%以上的溴元素存在于海洋中,资料显示海水中溴的含量约为66mgL﹣1 . 如图中制备溴涉及步骤I、II、III,分别写出步骤II和步骤III中反应的离子方程式:、 .
(2)制备镁的工艺中,从卤水到MgCl2(aq)经历了 ![]() 的过程,生成Mg(OH)2的过程看似多余,其实该过程的作用是 .
的过程,生成Mg(OH)2的过程看似多余,其实该过程的作用是 .
(3)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用作镁蒸气的冷却剂的是(填字母序号).
A.Ar
B.CO2
C.O2
D.N2 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com