
����Ŀ��H��C��N��O����������Ȼ���г����ǽ���Ԫ�أ�
��1��O��C��N����Ԫ�صĵ�һ��������С����˳������NH4+�е�ԭ�ӹ�����ӻ�����Ϊ ��
��2��CO��N2�Ľṹ�ɱ�ʾΪ��C��O��N��N���ߵļ������ݣ�����λkJ/mol��
A��B | A=B | A��B | |
CO | 357.7 | 798.9 | 1071.9 |
N2 | 154.8 | 418.4 | 941.7 |
�������˵��CO��N2���õ�ԭ�� ��
��3���Ҷ�����H2N��CH2��CH2��NH2�������װ�[N��CH3��3]�����ڰ������Ҷ��������װ��ķе�ߵĶ࣬ԭ���� ��
��4��C��NԪ���γɵ��²��Ͼ�������ͼ��ʾ�ṹ���þ���Ӳ�Ƚ�����Ŀǰ��������Ӳ�Ľ��ʯ����Ϊ����һָ�ij�Ӳ�²��ϣ������ʵĻ�ѧʽΪ�� �� 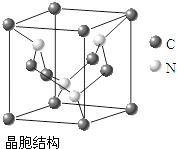
���𰸡�
��1��C O N��sp3�ӻ�
��2��CO�ĵ�һ���м��ļ���Ϊ273kJ/mol��N2�еĵ�һ���м��ļ���Ϊ523.3kJ/mol������CO�ĵ�һ������N2��������
��3���Ҷ������Ӽ�����γ���������װ����Ӽ䲻���γ����
��4��C3N4
���������⣺��1��ͬһ����Ԫ�صĵ�һ����������ԭ�����������������������ƣ�����IIA��͵�VA��Ԫ�صĵ�һ�����ܴ�������Ԫ�أ�����C��N��O����Ԫ�صĵ�һ�������ɴ�С��˳��Ϊ��N��O��C��NH4+�е�ԭ�Ӻ���4�����ۼ��������������ӻ�����sp3�ӻ���
���Դ��ǣ�N��O��C��sp3�ӻ�����2�����ݱ������ݿ�֪������C��O�е�һ���м����ĵ�������1071.9kJ/mol��798.9kJ/mol=273kJ/mol������N��N�е�һ���м����ĵ�������941.7kJ/mol��418.4kJ/mol=523.3kJ/mol������һ���м�CO��N2�����ף�����CO�����ã�
���Դ��ǣ�CO�ĵ�һ���м��ļ���Ϊ273kJ/mol��N2�еĵ�һ���м��ļ���Ϊ523.3kJ/mol������CO�ĵ�һ������N2�������ѣ���3���Ҷ�����H2N��CH2��CH2��NH2������֮������γ���������װ�[N��CH3��3]����֮�䲻���γ���������Ҷ����ķе�ϸߣ�
���Դ��ǣ��Ҷ������Ӽ�����γ���������װ����Ӽ䲻���γ��������4���þ����к���̼ԭ�Ӹ���=8�� ![]() +4��
+4�� ![]() =3��Nԭ�Ӹ���Ϊ4�������仯ѧʽΪC3N4 �� ���Դ��ǣ�C3N4 ��
=3��Nԭ�Ӹ���Ϊ4�������仯ѧʽΪC3N4 �� ���Դ��ǣ�C3N4 ��
�����㾫����ͨ�������������Ĵ��ڶ��������ʵ�Ӱ�죬���������Ҫ������HF��H2O��NH3��CH3CH2OH���Ӽ䣻��HF��H2O��NH3�ķе�ֱ���ͬ���⻯��е���ȷ����ĸ����Խ����⣮


 �߽�������ϵ�д�
�߽�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����и�������һ�����Դ����������
A��ǿ������Һ�У�Na����HCO3����SO32-��K��
B��������Ca2+����Һ��Cl����Na����CO32����NO32��
C��pH>7����Һ�У�Mg2����Br����K����Al3��
D������Fe�ܷų�H2����Һ�У�Cl����Mg2����SO42-��K��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ�����и���������ָ����Һ��һ���ܴ���������ǣ� ��
A.����ʯ����Һ����ɫ����Һ�У�K+��Na+��HSO ![]() ��ClO��
��ClO��
B.0.1mol/L��Fe��NO3��3��Һ�У�Na+��H+��Cl����I��
C.0.1mol/L��NaAlO2��Һ�У�K+��H+��NO ![]() ��SO
��SO ![]()
D.��ɫ����ˮ��Һ�У�Mg2+��H+��Cl����SO ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������¡�������ٷ�չ�������Ⱥ��¡������ţ��������ȶ��ֶ����¡�����Ĺؼ����ҵ�һЩ�����ø����Щø�ܼ�����ͨ��ϸ����ʹ֮������ֳϸ��һ�������ɸ��塣�����й�ø�������д������( )
A.ø�ǻ�ϸ�������ľ��д����õ��л�������ø�ǵ�����
B.ø�Ĵ����þ���רһ��
C.���»��ؽ������ܽ���ø�Ļ���
D.øֻ����ǿ���ǿ��������²��ܷ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ij�л���ȼ��ֻ����CO2��H2O���Ҷ������ʵ�����ȣ�����л�������ΪCnH2n
B. ��ȩ�ͱ�ϩȩ(![]() )����ͬϵ�������������ַ�Ӧ�����Ҳ����ͬϵ��
)����ͬϵ�������������ַ�Ӧ�����Ҳ����ͬϵ��
C. CH3COOCH2CH3��CH3CH2COOCH3��Ϊͬ���칹�壬1H��NMR����ʾ���߾������ֲ�ͬ����ԭ����������ԭ�ӵı�����ͬ���ʲ�����1H��NMR������
D. ֲ���Ͳ��ϵμӵ���ˮ�У���ˮ��dzֱ����ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮɹ�ε�ԭ���ǣ� ��
A.��ˮ�ֽ�
B.�¶����ߣ��������ʵ��ܽ������
C.�����¶ȣ�����ʳ����ˮ�е��ܽ��
D.�������⡢��������ˮ��ʹ�Ȼ��Ƴɾ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������������ȷ���ǣ� ��
A.��״���£�11.2 L SO3��������ԭ����Ϊ1.5NA
B.��⾫��ͭʱ����������������6.4 g�����·��ת�Ƶ�����Ϊ0.2NA
C.���³�ѹ�£�7.8 gNa2S��Na2O2�Ļ�����У�����������������Ϊ1.8 NA
D.�ں�Al3+����ΪNA��AlCl3��Һ�У�Cl������Ϊ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����aXm+��bYn-�ĺ�������Ų���ͬ�����й�ϵʽ��ȷ����( )
A. b=a-n+mB. b=a-n-m
C. ���Ӱ뾶Xm+��Yn+D. ԭ�Ӱ뾶X��Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʹ�Ȼ�ɫ��ˮ�����ɫ��Һ����
A.п��B.�����Ȼ�̼�����ȡ
C.����������ҺD.�⻯����Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com