
【题目】有机物I (分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。
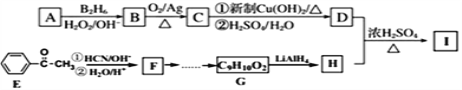
已知:①![]() ;
;![]()
②有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;有机物H是苯甲醇的同系物,苯环上只有一个侧链。回答下列问题:
(1)用系统命名法命名有机物A___________________;
(2)B的结构简式为_____________________________________;
(3)F→G经历两步反应,反应类型依次为____________,_____________。
(4)C→D第①步反应的化学方程式为_________________________________。
(5)F在一定条件下能形成一种聚酯类化合物,写出该反应的化学方程式___________________________________________________________。
(6)己知有机物甲符合下列条件:①为芳香族化合物;②与H互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有_______种, 写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的有机物的结构简式_______;
(7)参照上述合成路线以丙酮等为原料合成D (无机试剂任选)______________。
【答案】 2一甲基-1-丙烯(或2一甲基丙烯) 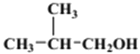 消去反应 加成反应(或还原反应)
消去反应 加成反应(或还原反应) 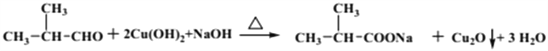
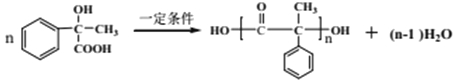 13种
13种 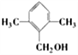 或
或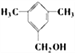 (
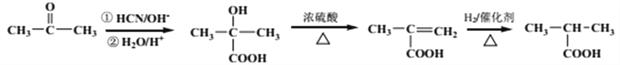
( 
【解析】分析:由信息可知A为不对称烯烃,B为醇,经催化氧化得醛C,C与新制Cu(OH)2反应生成羧酸钠,再经酸化处理得羧酸D,由D的摩尔质量和核磁共振氢谱可确定D的结构简式,D与H发生酯化反应生成I,则H为醇,根据质量守恒由I和D的分子式可推出H的分子式,结合H的信息,推出醇H的结构简式。已知E为酮,由信息可得F为羟基羧酸,而G为羧酸,经还原得醇H,可见F→G要先脱水再加氢。
详解:(1)由反应条件可确定D为羧酸,其摩尔质量为88 g·mol-1,核磁共振氢谱有3组峰,可推知D为(CH3)2CHCOOH,逆向推导可得A为(CH3)2C=CH2,其名称为2-甲基-1-丙烯(或2-甲基丙烯)。
(2)由A的结构简式,结合信息①可推知B的结构简式为(CH3)2CHCH2OH。
(3)由E的结构简式,结合信息①可推知F的结构简式为![]() ,分子式为C9H10O3,而G的分子式为C9H10O2,所以F→G时要先在浓硫酸作用下消去羟基,再用H2与C=C加成,因此这两步的反应类型分别为消去反应和加成反应(或还原反应)。
,分子式为C9H10O3,而G的分子式为C9H10O2,所以F→G时要先在浓硫酸作用下消去羟基,再用H2与C=C加成,因此这两步的反应类型分别为消去反应和加成反应(或还原反应)。
(4) C→D经过两步反应,一是与新制Cu(OH)2反应生成羧酸钠,再酸化处理得羧酸D,所以第一步反应的化学方程式为(CH3)2CHCHO+2 Cu(OH)2+NaOH![]() (CH3)2CHCOONa+ Cu2O↓+3H2O。
(CH3)2CHCOONa+ Cu2O↓+3H2O。
(5) F的结构简式为![]() ,分子中既有羟基,又有羧基,在一定条件下可发生聚酯反应,方程式为
,分子中既有羟基,又有羧基,在一定条件下可发生聚酯反应,方程式为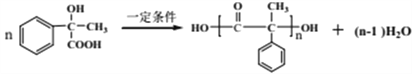 。
。
(6)已知I的分子式为C13H18O2,D为羧酸(CH3)2CHCOOH,根据酯化反应中原子守恒可得醇H的分子式为C13H18O2+H2O- C4H8O2= C9H12O,其同分异构体中能被氧化为醛的物质一定含有原子团—CH2OH,则其同分异构体有![]() 1种,
1种,![]() 有邻间对3种,
有邻间对3种,![]() 有邻间对3种,
有邻间对3种,![]() 的结构中,两个甲基在邻、间、对时,分别有2种、3种和1种,所以有机物甲一共有13种,其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的结构简式为
的结构中,两个甲基在邻、间、对时,分别有2种、3种和1种,所以有机物甲一共有13种,其中满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6:2:2:1:1的结构简式为![]() 或
或![]() 。
。
(7)以丙酮等为原料,根据信息①先转化为羟基羧酸,经脱水去掉羟基,再与H2加成即得D。其转化过程为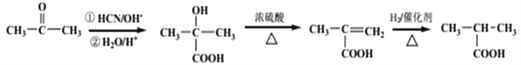 。
。


 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案科目:高中化学 来源: 题型:
【题目】某同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4 +8H2O设计如下原电池,盐桥中装有饱和KCl溶液。下列说法正确的是

A. b电极上发生还原反应
B. 外电路电子的流向是从a到b
C. 电池工作时,盐桥中的SO42-移向甲烧杯
D. a电极上发生的反应为:MnO4-+8H++5e- = Mn2++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝、磷化锌、磷化钙与水反应产生高毒的PH3气体(熔点为-132℃,还原性强、易自燃),可用于粮食熏蒸杀虫。卫生安全标准规定:当粮食中磷化物(以PH3计)的含量低于0.05mg·kg-1时算合格。可用以下方法测定粮食中残留的磷化物含量:

(操作流程)安装吸收装置→PH3的产生与吸收→转移KMnO4吸收溶液→亚硫酸钠标准溶液滴定。
(实验装置)C中盛100 g原粮,D中盛有 20.00 mL 1.12×10-4 mol L-1KMnO4溶(H2SO4酸化)。
请回答下列问题:
(1)仪器C的名称是__________________;
(2)以磷化钙为例,写出磷化钙与水反应的化学方程式____________________;检查整套装置气密性良好的方法是_____________________________________。
(3)A中盛装KMnO4溶液的作用是______________________;通入空气的作用是____________。若没有B装置,则实验中测得PH3含量将____________(填“偏低”、“偏高”或“不变”)
(4)D中PH3被氧化成磷酸,所发生反应的离子方程式为_________________________。
(5)把D中吸收液转移至容量瓶中,加水稀释至250mL,取25.00mL于锥形瓶中,用5.0×10-5mol L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液11.00mL,则该原粮中磷化物(以PH3计)的含量为______mg kg-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL0.1mol/L的某一元酸HR溶液中逐滴加入0.1mol/L氨水,所得溶液pH及导电能力变化如图。下列分析不正确的是( )

A. a~b点导电能力增强说明HR为弱酸
B. a、b点所示溶液中水的电离程度不相同
C. b恰好完全中和,pH=7说明NH4R没有水解
D. c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
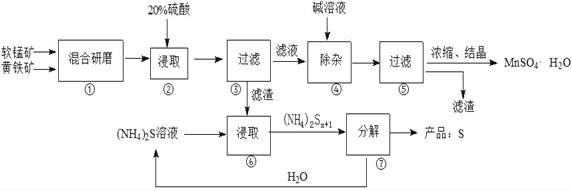
【题目】一种用软锰矿(主要成分MnO2)和黄铁矿(主要成分FeS2) 制取MnSO4·H2O并回收单质硫的工艺流程如下:
已知:本实验条件下,高锰酸钾溶液与硫酸锰溶液混合产生二氧化锰。
回答下列问题:
(1)步骤①混合研磨成细粉的主要目的是_____________________________________________;步骤②浸取时若生成S、MnSO4及Fe2(SO4)3的化学方程式为_____________________________________。
(2)步骤③所得酸性滤液可能含有Fe2+,为了除去Fe2+可先加入______________________;步骤④需将溶液加热至沸然后在不断搅拌下加入碱调节pH为4~5,再继续煮沸一段时间,“继续煮沸”的目的是_____________________________________。步骤⑤所得滤渣为__________________(填化学式)。
(3)步骤⑦需在90~100℃下进行,该反应的化学方程式为_________________________________。
(4)测定产品MnSO4·H2O的方法之一是:准确称取a g产品于锥形瓶中,加入适量ZnO及H2O煮沸,然后用c mol·L-1KMnO4标准溶液滴定至浅红色且半分钟不褪色,消耗标准溶液VmL,产品中Mn2+的质量分数为w(Mn2+)=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、 F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
元素 | 有关性质或结构信息 |
A | 地壳中含量最多的元素 |
B | B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
C | C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
D | D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
E | E与D同周期,且在该周期中原子半径最小 |
F | F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
G | G是形成化合物种类最多的元素 |
(1) B元素符号为____,A与C以原子个数比为1:1形成的化合物的电子式为___,用电子式表示C与E形成化合物的过程____, D形成的简单离子的结构示意图为____。
(2) F的氢化物是由____(极性或非极性)键形成的分子,写出实验室制备该氢化物的化学方程式____。
(3) 非金属性D____E(填大于或小于),请从原子结构的角度解释原因:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解精炼铜的阳极泥中主要含Ag、Au等贵重金属。以下是从精炼铜的阳极泥中回收银、金的流程图:
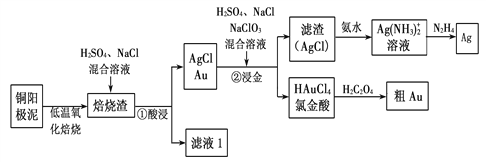
(1)氯金酸(HAuCl4)中的Au的化合价为________。
(2)“焙烧渣”在“①酸浸”时发生反应的离子方程式为_________。
(3)铜阳极泥氧化时,采用“低温焙烧”而不采用“高温焙烧”的原因是________。
(4)已知N2H4被银氨溶液氧化的产物是氮气,则每生成1molAg,需要消耗_______g N2H4。
(5)氯金酸(HAuCl4)在pH为2~3的条件下被草酸还原为Au,同时放出二氧化碳气体,则该反应的化学方程式为____________。
(6)阳极泥中的铜可以用FeC13溶液浸出,所得溶液主要含有的阳离子为Cu2+、Fe3+和Fe2+;结合右图分析(其中的纵坐标代表金属阳离子浓度的对数):
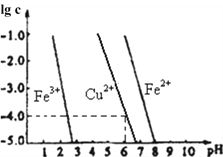
①要从浸出液中提纯铜,最好先加入酸化的双氧水,目的是___________________________________,然后加入适量的CuO调节pH=3.7,除去________离子;
②从图中数据计算可得Cu(OH)2的Ksp约为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 金属钠与水反应:Na +2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
B. 用氢氧化钡溶液中和硫酸溶液:Ba2++OH-+H++SO42-![]() H2O+BaSO4↓
H2O+BaSO4↓
C. 氯化铝溶液中加入过量的氨水:Al3++ 4NH3·H2O ![]() AlO2- + 4NH4++ 2H2O
AlO2- + 4NH4++ 2H2O
D. 在澄清石灰水中通入过量的CO2:OH-+CO2![]() HCO3-
HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
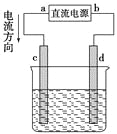
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com