
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.常温下100mL0.1mol/L醋酸溶液中含H+为0.01NA
B.1molNa与足量O2反应生成Na2O和Na2O2的混合物共失去NA个电子
C.物质的量浓度为0.5 mol·L-1的MgCl2溶液,含有Cl-数为 NA
D.7.8gNa2O2的固体中含有的阴离子数0.2NA
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种短周期元素,已知C、D元素的原子序数之和是A、B元素的原子序数之和的3倍,且C、D元素是同主族元素。甲、乙、丙、丁、戊五种二元化合物的组成如下表:

物质间存在反应:甲+乙→单质B+丙;丁+戊→单质D(淡黄色固体)+丙。下列说法正确的是( )
A.甲、乙、丙、丁、戊均为只含极性键的极性分子
B.原子半径:D>B>C;电负性:B>C>D
C.可用酒精洗涤粘在容器内壁上的单质D
D.若2mol甲与3mol乙恰好反应生成2.5mol单质B,则乙为双原子分子
查看答案和解析>>
科目:高中化学 来源: 题型:
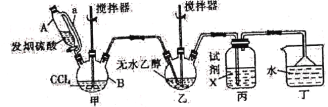
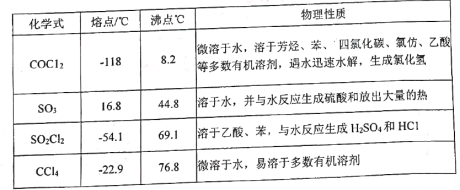
【题目】碳酸二乙酯(![]() )常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
)常温下为无色清澈液体。主要用作硝酸纤维素、树脂和一些药物的溶剂,或有机合成的中间体。现用下列装置制备碳酸二乙酯。
回答下列问题:
(1)甲装置主要用于制备光气(COCl2),先将仪器B中的四氯化碳加热至55~60℃,再缓缓滴加发烟硫酸。
①仪器B的名称是____________。②仪器A的侧导管a的作用是______________________。
(2)试剂X是____________,其作用是_____________________________________________。
(3)丁装置除了吸收COCl2外,还能吸收的气体是____________(填化学式)。仪器B中四氯化碳与发烟硫酸(用SO3表示)反应只生成两种物质的量为1:1的产物,且均易与水反应,写出该反应化学方程式:________________________________________________。
(4)无水乙醇与光气反应生成氯甲酸乙酯,再继续与乙醇反应生成碳酸二乙酯。
①写出无水乙醇与光气反应生成氯甲酸乙酯的化学方程式:__________________________。
②若起始投入92.0g无水乙醇,最终得到碳酸二乙酯94.4g,则碳酸二乙酯的产率是______(三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)
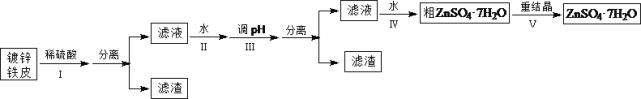
相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
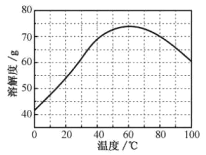
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。
请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是_______________________________。②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是_______________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是_______________________________。
(3)步骤Ⅲ,合适的pH范围是_______________________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序___________________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如图1所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_________方式进行冷却结晶。
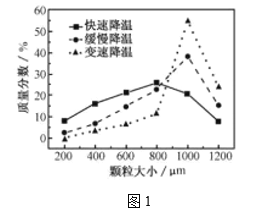
A.快速降温 B. 缓慢降温 C.变速降温
(6)ZnSO4·7H2O产品的纯度可用配位滴定法测定。
① 下列关于滴定分析,正确的是________________。
A.图2中,应将凡士林涂在旋塞的a端和旋塞套内的c端

B.滴定前,锥形瓶和滴定管均须用标准溶液润洗
C.将标准溶液装入滴定管时,应借助烧杯或漏斗等玻璃仪器转移
D.滴定时,通常用左手控制旋塞滴加溶液,右手摇动锥形瓶,使溶液向同一方向旋转
E.滴定前滴定管尖嘴内无气泡,滴定后尖嘴内有气泡,则测得的体积比实际消耗的小
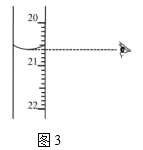
②图3中显示滴定终点时的度数是_____________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】维生素C又称抗坏血酸,能增强对传染病的抵抗力,有解毒作用等,其结构式为 ,下列有关说法错误的是
,下列有关说法错误的是
A.维生素C分子式为C6H8O6
B.维生素C的同分异构体中可能有芳香族化合物
C.向维生素C溶液中滴加紫色石蕊试液,溶液颜色变红,说明维生素C溶液显酸性
D.在一定条件下,维生素C能发生氧化反应、加成反应、取代反应和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuCl是应用广泛的有机合成催化剂,可从黄铜矿(主要成分为CuFeS2)中制取。

已知:CuCl是一种白色粉末,微溶于水,难溶于乙醇,在空气中易被氧化,在水溶液中存在平衡:CuCl(s)+2Cl-(aq)[CuCl3]2-(aq)(无色溶液)。下列叙述正确的是
A.“浸取”过程中的主要反应为CuFeS2+4CuCl2=4CuCl+FeCl2+2S
B.浸取所得到的FeCl2溶液,可用来腐蚀覆在绝缘板上的铜箔制造印刷电路板
C.加水有利于CuCl(s) +2Cl-(aq)[CuCl3]2-(aq)平衡逆向移动,析出CuCl,Cl-浓度增大
D.为提高产率和纯度,可采用乙醇洗涤、真空干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、铁及它们的化合物在生产、生活中有着重要的用途。
(1)某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质。当汽车发生碰撞时,NaN3迅速分解产生N2和Na,同时放出大量的热。N2使气囊迅速膨胀,从而起到保护作用。KClO4中氯元素的化合价是_________,具有_________(填“还原性”或“氧化性”);Fe2O3可处理产生的Na,反应为6Na + Fe2O3 =3Na2O + 2Fe,反应中Na做_________(填“还原剂”或“氧化剂”)。
(2)甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe粉和稀H2SO4 , B管中是NaOH溶液,请回答下列问题:
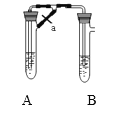
①同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是____________写出B中发生反应的所有离子方程式:___________________
②同学乙:打开a,使A管中反应一段时间再夹紧止水夹a,实验中在B管中观察到的现象是__________ ;
③同学乙打开a的目的______________,根据以上实验判断___________(填甲或乙)同学可成功。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Fe2+、I-、Br-的溶液中通入适量Cl2,溶液中各种离子的物质的量变化如图所示。下列有关说法正确的是( )
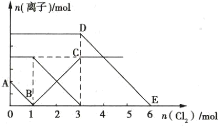
A.线段BC代表Cl-物质的量的变化情况
B.原混合溶液中c(FeBr2)=6mol·L-1
C.当通入2mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-
D.原溶液中n(Fe2+):n(I-):n(Br-)=2:2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学参阅了“84消毒液”说明中的配方,欲用NaClO固体配制480mL含NaClO25%,密度为1.19g/cm3的消毒液.下列说法正确的是
A. 配制过程只需要三种仪器即可完成
B. 容量瓶用蒸馏水洗净后必须烘干才能用于溶液的配制
C. 定容时俯视容量瓶的刻度线,会造成所配溶液物质的量浓度偏低
D. 需用托盘天平称量的NaClO固体的质量为148.8g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com