
����Ŀ��Һ��ȼ�ϵ�����������ȼ�ϵ�ؾ������С����������洢װ�õ��ŵ㡣һ�����£�N2H4��Ϊȼ�ϵĵ��װ����ͼ��ʾ���õ���ÿ����е�������Ϊ��������KOH��Ϊ����ʡ����й��ڸ�ȼ�ϵ�ص���������ȷ���ǣ�������

A. �������Ҳ�缫�������غ��������缫
B. ���������ĵ缫��ӦʽΪ��N2H4+4OH-+4e-=N2+4H2O
C. ��ȼ�ϵ�صĵ缫����Ӧ���ö������ϣ�����ߵ缫��Ӧ�����ڵ缫���������������ʹ������������Һ��ֽӴ�
D. �õ�س����ŵ�ʱ��K+�Ӹ���������Ǩ�ƣ�������ӽ���Ĥ��ѡ�������ӽ���Ĥ
���𰸡�D
��������
A����ȼ�ϵ���У��Ҳ�ͨ�������������ĵ缫bΪ�������������������������������Ҳ�缫�������غ��������缫����A��ȷ��B��ͨ��ȼ�ϵĵ缫Ϊ������������ȼ��ʧ���ӷ���������Ӧ���缫��ӦʽΪ��N2H4+4OH--4e-=N2��+4H2O����B��ȷ��C����Ϊ�������������Ϊ�������ķ�Ӧ�����Բ��ö������ϣ�������ߵ缫��Ӧ�����ڵ缫���������������ʹ������������Һ��ֽӴ�����C��ȷ��D����ԭ����У��������������������ӣ��������ӽ���ĤҪѡȡ�����ӽ���Ĥ����D����ѡD��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.1 mol/L CH3COOH��Һ�д������µ���ƽ�⣺CH3COOH![]() CH3COO-+H+�����ڸ�ƽ�⣬����������ȷ����( )
CH3COO-+H+�����ڸ�ƽ�⣬����������ȷ����( )
A������ˮʱ��ƽ�����淴Ӧ�����ƶ�
B����������NaOH���壬ƽ��������Ӧ�����ƶ�
C����������0.1 mol/L HCl��Һ����Һ��c(H+)����
D����������CH3COONa���壬ƽ��������Ӧ�����ƶ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ��ͭ����Ʒ�Ʋ����������Ʒ������ǰ����������
B. ��״���£�22.4 L Cl2������NaOH��Һ��Ӧ��ת�Ƶ�����Ϊ2mol
C. ˮ�����ӻ�����Kw�����¶ȵ����߶�����˵��ˮ�ĵ����Ƿ��ȷ�Ӧ
D. Na2CO3��Һ�м�������Ca(OH)2���壬CO32��ˮ��̶ȼ�С����Һ��pH��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����5 �ֶ�����Ԫ�ص�ԭ��������E��D��B��A��C��˳����������A��Cͬ���ڣ�B��Cͬ���壻A��B���γ����ӻ�����A2B��A2B���������ӵĵ�������ͬ���ҵ�������Ϊ30��D��E���γ�4��10���ӵķ��ӡ��Իش��������⣺
��1��д������Ԫ�ص����ƣ�A B C D ��
��2���õ���ʽ��ʾ���ӻ�����A2B���γɹ��̣�
��3��д���������ʵĵ���ʽ��
DԪ���γɵĵ��� ��B��E�γɵĻ����� ��
A��B��E�γɵĻ����� ��D��E�γɵĻ����� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������������������������������������ǣ� ��
A.D3O+
B.Li+
C.OD��
D.OH��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I. ![]() U����Ҫ�ĺ˹�ҵԭ�ϣ�����Ȼ��ķ�Ⱥܵ͡�
U����Ҫ�ĺ˹�ҵԭ�ϣ�����Ȼ��ķ�Ⱥܵ͡�![]() U��Ũ��һֱΪ��������ע���ش������й����⣺
U��Ũ��һֱΪ��������ע���ش������й����⣺
(1)![]() U��ʾ�ĺ�����________________��
U��ʾ�ĺ�����________________��
(2)![]() U��
U��![]() U��
U��![]() ��Ϊͬλ�أ����ж�ͬλ�ص����ⲻ��ȷ����________(����ţ���ͬ)��
��Ϊͬλ�أ����ж�ͬλ�ص����ⲻ��ȷ����________(����ţ���ͬ)��
A��Ԫ�ط�����ͬ B������������ͬ
C����ѧ���ʻ�����ͬ D�������ڱ���λ����ͬ
(3)�����й�![]() U˵������ȷ����________��
U˵������ȷ����________��
A.![]() Uԭ�Ӻ˵���������������֮��Ϊ51
Uԭ�Ӻ˵���������������֮��Ϊ51
B.![]() U��
U��![]() U���������������������
U���������������������
C.![]() U��
U��![]() U��������������ͬ����������ͬ��ԭ��
U��������������ͬ����������ͬ��ԭ��
D.![]() U��
U��![]() U��ͬ��ԭ��
U��ͬ��ԭ��
��.﮵IJ�������������й㷺Ӧ�ã����ǰ����(Li2NH)��һ�ִ��������ߡ���ȫ�ԺõĹ��崢����ϣ�LiCoO2����Яʽ��Դ���������ϣ�̼���(Li2CO3)�㷺Ӧ�����մɺ�ҽҩ������������Ҫ��ش�������⣺
(1)Li��Li���˷�Ӧ����������壬LiH��LiD�����¶Ѽ��ټ�������˵���� ��ȷ����________(����ţ���ͬ)��
A.Li��Li��Ϊͬλ�� B.Li��Li����ͬ�ֺ���
C.LiH��LiD�Ļ�ѧ���ʲ�ͬ D.LiH��LiD��ͬ������
(2)����˵������ȷ����________��
A�����ԣ�Be(OH)2<LiOH<NaOH<KOH B���뾶��K>Na>Li>Li��
C�������ԣ�Li��<Na��<K��<Rb��<Cs�� D�������ԣ�Cs>Rb>K>Na>Li>Be
(3)��Ǽ��������Ԫ�أ����������Բ�ͬ��������������ʣ�������֧����һ�۵��������________��
A���������ˮ��Ӧ B���������������ȼ��
C���������������Ӧ D���������������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ԫ�أ�Ce������ϵ��������Ȼ�����ߵ�һ�֣�������̬��+3��+4����ĺϽ����£������������������ƽ��������
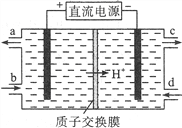
��1�������к��д�������Ⱦ��NO�����Ա�Ce4+��Һ���գ�����NO2����NO3�����������ʵ���֮��Ϊ1��1�����÷�Ӧ�������뻹ԭ�������ʵ���֮��Ϊ___________��
��2���ɲ��õ�ⷨ����������Һ�е�NO2��ת��Ϊ�����ʣ�ͬʱ����Ce4+����ԭ������ͼ��ʾ��
��Ce4+�ӵ��۵�__________������ĸ���)��������
��д�������ĵ缫��Ӧʽ____________________________��ÿ����1mol NO2����������H+���ʵ�������______mol��
��3����Ԫ������Ȼ����Ҫ�Է�̼����ʽ���ڣ���Ҫ��ѧ�ɷ�ΪCeFCO3����ҵ�����÷�̼�����ȡCeCl3��һ�ֹ����������£�
�����չ����з�������Ҫ��Ӧ����ʽΪ______________________________________��
�������������ͬѧ��Ϊ��ϡ�����H2O2�滻������ã�����������_________________________��
��Ce(BF4)3��KBF4��Ksp�ֱ�Ϊa��b����Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)ƽ�ⳣ��Ϊ______________________��
3KBF4(s) + CeCl3 (aq)ƽ�ⳣ��Ϊ______________________��
������CeCl3��6H2O��NH4Cl�Ĺ�������ɵõ���ˮCeCl3������NH4Cl��������______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и��������У���ѧ��������ͬ����������Ҳ��ͬ���� �� ��
A. C�����ʯ����CO2 B. NaBr��HBr C. CH4��H2O D. Cl2��KCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҽ���Ȼ��ƿ������������ơ������������ȣ��Թ�ҵ̼��ƣ�������Na+��Al3+��Fe3+������)����ҽҩ����ˮ���Ȼ���(CaCl2��2H2O����������Ϊ97.0%��103.0%)����Ҫ�������£�
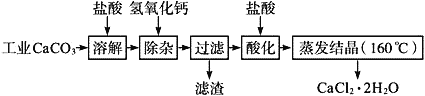
��֪��
�������� | Fe��OH��3 | Al��OH��3 | Al��OH��3 | |
��ʼ����ʱ��pH | 2.3 | 4.0 | ��ʼ�ܽ�ʱ��pH | 7.8 |
��ȫ����ʱ��pH | 3.7 | 5.2 | ��ȫ�ܽ�ʱ��pH | 10.8 |
��1��CaCO3�����ᷴӦ�����ӷ���ʽ___________��
��2�������ӡ������Ǽ����������ƣ�������Һ��pH��ΧΪ________��Ŀ���dz�ȥ��Һ�е�����Al3+��Fe2+��
��3������ʱ���õıȲ�������__________��
��4�����ữ�������Ǽ������ᣬ������Һ��pHԼΪ4.0����Ŀ���У�����ֹ�����������տ����еĶ�����̼������ֹCa2+������ʱˮ�⣻��_______��
��5�������ᾧҪ������160����ԭ����__________��
��6���ⶨ��Ʒ��Cl-�����ķ����ǣ���ȡ0.750 0 gCaCl2��2H2O��Ʒ���ܽ⣬��250 mL����ƿ�ж��ݣ���ȡ25.00 mL������Һ����ƿ�У���0.050 00 mol/L AgNO3��Һ�ζ����յ㣨��K2Cr2O2��������AgNO3��Һ�����ƽ��ֵΪ20.39 mL��
�������ⶨ������������Һ��ϴ��������________��
������������Ʒ��CaCl2��2H2O����������Ϊ_______����������λ��Ч���֣�
���������������ⶨ����Ʒ��CaCl2��2H2O����������ƫ��(�ⶨ�����в��������ɺ���)�������ԭ����________��__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com