
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见价态有+3、+4,铈的合金耐高温,可以用来制造喷气推进器零件。
(1)雾霾中含有大量的污染物NO,可以被Ce4+溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1),该反应氧化剂与还原剂的物质的量之比为___________。
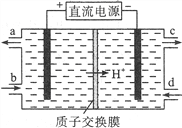
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如右图所示。
①Ce4+从电解槽的__________(填字母序号)口流出。
②写出阴极的电极反应式____________________________。每消耗1mol NO2-,阴极区H+物质的量减少______mol。
(3)铈元素在自然中主要以氟碳矿形式存在,主要化学成分为CeFCO3,工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:
①焙烧过程中发生的主要反应方程式为______________________________________。
②酸浸过程中有同学认为用稀硫酸和H2O2替换盐酸更好,他的理由是_________________________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是______________________。
【答案】2:1a2NO2 - +8H++6e—=N2↑+4H2O14CeFCO3+ O2![]() 3 CeO2+ CeF4+4CO2不释放氯气,减少对环境的污染
3 CeO2+ CeF4+4CO2不释放氯气,减少对环境的污染![]() NH4Cl固体分解出HCl气体,抑制CeCl3水解
NH4Cl固体分解出HCl气体,抑制CeCl3水解
【解析】(1)NO被Ce4+溶液氧化为NO2-、NO3-(二者物质的量之比为1∶1),Ce4+被还原为Ce3+,该反应的离子方程式为4 Ce4++2NO+3H2O==4 Ce3+ +NO2-+NO3-+6H+,Ce4+为氧化剂,NO为还原剂,二者的物质的量之比为2:1。
(2)采用电解法将吸收液中的NO2-转化为无毒物质N2,发生还原反应,电极反应式为2NO2 - +8H++6e—=N2↑+4H2O,Ce3+被氧化为Ce4+,电极反应式为Ce3+-e-=Ce4+。①分析电解装置知左侧电极为电解池的阳极,电极反应式为Ce3+-e-=Ce4+,故Ce4+从电解槽的a口流出。②右侧电极为电解池的阴极,发生还原反应,电极反应式为2NO2 - +8H++6e—=N2↑+4H2O ;根据电极反应式和电荷守恒知每消耗1mol NO2-,阴极区H+物质的量减少1mol。
(3)①焙烧过程中,CeFCO3和 O2反应生成CeO2、 CeF4和CO2,利用化合价升降法配平,反应方程式为4CeFCO3+ O2![]() 3 CeO2+ CeF4+4CO2 。②酸浸过程中,+4价Ce被还原为+3价,HCl被氧化生成有毒气体氯气,污染环境。用稀硫酸和H2O2替换盐酸,H2O2的氧化产物为氧气,不释放氯气,减少对环境的污染 。③反应:Ce(BF4)3(s) + 3K+(aq)
3 CeO2+ CeF4+4CO2 。②酸浸过程中,+4价Ce被还原为+3价,HCl被氧化生成有毒气体氯气,污染环境。用稀硫酸和H2O2替换盐酸,H2O2的氧化产物为氧气,不释放氯气,减少对环境的污染 。③反应:Ce(BF4)3(s) + 3K+(aq)![]() 3KBF4(s) + Ce3+(aq)的平衡常数K=c(Ce3+)/c3(K+),Ce(BF4)3的Ksp= c(Ce3+) c3(BF4-)=a,KBF4的Ksp= c(K+) c(BF4-)=b,则Ce(BF4)3(s) + 3KCl(aq)
3KBF4(s) + Ce3+(aq)的平衡常数K=c(Ce3+)/c3(K+),Ce(BF4)3的Ksp= c(Ce3+) c3(BF4-)=a,KBF4的Ksp= c(K+) c(BF4-)=b,则Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)平衡常数K=Ksp[Ce(BF4)3]/ Ksp3(KBF4)=
3KBF4(s) + CeCl3 (aq)平衡常数K=Ksp[Ce(BF4)3]/ Ksp3(KBF4)=![]() 。④加热CeCl3·6H2O时,Ce3+水解,得不到无水CeCl3。加热CeCl3·6H2O和NH4Cl的固体混合物时,其中NH4Cl固体分解出HCl气体,抑制CeCl3水解。
。④加热CeCl3·6H2O时,Ce3+水解,得不到无水CeCl3。加热CeCl3·6H2O和NH4Cl的固体混合物时,其中NH4Cl固体分解出HCl气体,抑制CeCl3水解。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.某物质灼烧时焰色反应为黄色,则一定只含钠元素,不含其他元素
B.铝制品在生活中十分普遍,是因为铝不活泼
C.碳酸氢钠在医疗上可用于治疗胃酸过多
D.地壳中含量最多的金属是铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《神农本草经》说:“水银…熔化(加热)还复为丹。”《黄帝九鼎神丹经》中的“柔丹”“伏丹”都是在土釜中加热Hg制得的。这里的“丹”是指( )
A.氯化物 B.合金 C.硫化物 D.氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )

A. 电流从右侧电极经过负载后流向左侧电极
B. 负极发生的电极反应式为:N2H4+4OH-+4e-=N2+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以废铁屑为原料制备草酸亚铁晶体(FeC2O4·xH2O)。过程如下:

已知:①pH>4时,Fe2+易被氧气氧化;
②相关物质的溶解度曲线如图。

(1)①废铁屑在进行“溶解”前,需要在5%的Na2CO3 溶液中加热数分钟,并洗涤干净,Na2CO3溶液的作用是____________。
②用稀硫酸调溶液pH至1~2的目的:一是抑制Fe2+ 和NH4+的水解;二是 ________。
③操作I是为了得到(NH4)2SO4·FeSO4·6H2O,则操作I应进行蒸发浓缩、结晶、过滤。那么过滤时适宜的温度为__________。
④检验FeC2O4·xH2O沉淀是否洗涤干净的方法是____________。
(2)通常用已知浓度的酸性高锰酸钾溶液测定草酸亚铁晶体的纯度。已知酸性条件下MnO4-转化为Mn2+,写出MnO4-与Fe2+反应的离子方程式:____________。
(3)某研究性学习小组欲从硫铁矿烧渣(主要成分为Fe2O3、SiO2、Al2O3)出发,先制备较纯净的FeSO4溶液,再合成FeC2O4·xH2O。请补充完整由硫铁矿烧渣制备纯净FeSO4溶液的实验步骤(可选用的试剂:铁粉、稀硫酸和NaOH溶液):向一定量硫铁矿烧渣中加入足量的稀硫酸充分反应,过滤,____________,过滤,得到较纯净的FeSO4溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几种物质氧化性由强到弱顺序如下:KMnO4>Cl2>FeCl3>I2。则除去FeCl2溶液中混有的I–应选用 ( )
A. KMnO4 B. Cl2 C. I2 D. FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,越来越成为人们研制绿色原电池的关注焦点.其中一种镁原电池的反应为:xMg+Mo3S4![]() MgxMo3S4,下列说法正确的是( )
MgxMo3S4,下列说法正确的是( )
A. 电池放电时,Mg2+向负极迁移
B. 电池放电时,正极反应为Mo3S4+2xe﹣+xMg2+═MgxMo3S4
C. 电池充电时,阴极发生还原反应生成Mo3S4
D. 电池充电时,阳极反应为xMg﹣2xe﹣═xMg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为
A.大于10.00mL B.小于10.00mL C.等于10.00mL D.11.00mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】治理汽车尾气的方法之一是在汽车排气管上装一个“催化转换器”。发生的化学反应为:2CO+2NO = N2+2CO2 ,其中的氧化剂是
A. NO B.CO C.N2 D.CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com