
【题目】某学生用碱式滴定管量取0.1mol·L-1的NaOH溶液,开始时仰视液面读数为1.00mL,取出部分溶液后,俯视液面,读数为11.00mL,该同学在操作中实际取出的液体体积为
A.大于10.00mL B.小于10.00mL C.等于10.00mL D.11.00mL
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 镀铜铁制品镀层破损后,铁制品比破损前更容易生锈
B. 标准状况下,22.4 L Cl2与足量NaOH溶液反应,转移电子数为2mol
C. 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应
D. Na2CO3溶液中加入少量Ca(OH)2固体,CO32-水解程度减小,溶液的pH减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铈元素(Ce)是镧系金属中自然丰度最高的一种,常见价态有+3、+4,铈的合金耐高温,可以用来制造喷气推进器零件。
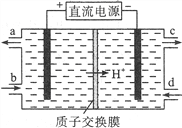
(1)雾霾中含有大量的污染物NO,可以被Ce4+溶液吸收,生成NO2-、NO3-(二者物质的量之比为1∶1),该反应氧化剂与还原剂的物质的量之比为___________。
(2)可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如右图所示。
①Ce4+从电解槽的__________(填字母序号)口流出。
②写出阴极的电极反应式____________________________。每消耗1mol NO2-,阴极区H+物质的量减少______mol。
(3)铈元素在自然中主要以氟碳矿形式存在,主要化学成分为CeFCO3,工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下:
①焙烧过程中发生的主要反应方程式为______________________________________。
②酸浸过程中有同学认为用稀硫酸和H2O2替换盐酸更好,他的理由是_________________________。
③Ce(BF4)3、KBF4的Ksp分别为a、b,则Ce(BF4)3(s) + 3KCl(aq)![]() 3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
3KBF4(s) + CeCl3 (aq)平衡常数为______________________。
④加热CeCl3·6H2O和NH4Cl的固体混合物可得到无水CeCl3,其中NH4Cl的作用是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,化学键类型相同,晶体类型也相同的是 ( )
A. C(金刚石)和CO2 B. NaBr和HBr C. CH4和H2O D. Cl2和KCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是__。
(2)装置乙中正极的电极反应式是__。
(3)装置丙中溶液的pH__(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1mol H2(g)和2mol I2(g)置于某2L密闭容器中,在一定温度下发生反应:H2(g)+ I2(g) ![]() 2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是( )
2HI(g) △H<0,达平衡,HI的体积分数ω(HI)随时间变化如图Ⅱ所示,若改变反应条件,ω(HI)的变化曲线如图Ⅰ所示,则改变的条件可能是( )

A.恒温恒容条件下,加入适当催化剂
B.恒温条件下,缩小反应容器体积
C.恒温条件下,扩大反应容器体积
D.恒容条件下升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如果n为第ⅠA族中X元素的原子序数,则原子序数为(n+2)的Y元素可能位于( )
①ⅡA ②ⅢA ③ⅣA ④ⅠB ⑤ⅡB ⑥ⅢB.
A.①④
B.②⑥
C.③⑤
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】医用氯化钙可用于生产补钙、抗过敏和消炎等,以工业碳酸钙(含少量Na+、Al3+、Fe3+等杂质)生产医药级二水合氯化钙(CaCl2、2H2O的质量分数为97.0%~103.0%)的主要流程如下:
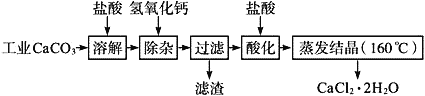
已知:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Al(OH)3 | |
开始沉淀时的pH | 2.3 | 4.0 | 开始溶解时的pH | 7.8 |
完全沉淀时的pH | 3.7 | 5.2 | 完全溶解时的pH | 10.8 |
(1)CaCO3与盐酸反应的离子方程式___________。
(2)“除杂”操作是加入氢氧化钙,调节溶液的pH范围为________,目的是除去溶液中的少量Al3+、Fe2+。
(3)过滤时需用的比玻璃器有__________。
(4)“酸化”操作是加入盐酸,调节溶液的pH约为4.0,其目的有:①防止氢氧化钙吸收空气中的二氧化碳;②防止Ca2+在蒸发时水解;③_______。
(5)蒸发结晶要保持在160℃的原因是__________。
(6)测定样品中Cl-含量的方法是:称取0.750 0 gCaCl2·2H2O样品,溶解,在250 mL容量瓶中定容;量取25.00 mL待测溶液于锥形瓶中;用0.050 00 mol/L AgNO3溶液滴定至终点(用K2Cr2O2),消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中需用溶液润洗的仪器有________。
②计算上述样品中CaCl2·2H2O的质量分数为_______。(保留四位有效数字)
③若用上述方法测定的样品中CaCl2·2H2O的质量分数偏高(测定过程中产生的误差可忽略),其可能原因有________;__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com