
【题目】人们应用原电池原理制作了多种电池,以满足不同的需要。以下每小题中的电池广泛使用于日常生活、生产和科学技术等方面,请根据题中提供的信息,填写空格。
(1)铅蓄电池在放电时发生的电池反应式为:Pb+PbO2+2H2SO4===2PbSO4+2H2O。负极电极反应式为___________________________________________。
(2)FeCl3溶液常用于腐蚀印刷电路铜板,发生2FeCl3+Cu===2FeCl2+CuCl2,若将此反应设计成原电池,则负极所用电极材料为________,当线路中转移0.2 mol电子时,则被腐蚀铜的质量为________g。
(3)燃料电池是一种高效、环境友好的供电装置,以甲醇做燃料的电池,如下图所示,

①负极反应物是______________,H+从________极到________极(填a或b)。
②正极反应式为_________________,负极反应式为___________________。
【答案】 Pb – 2e- + SO42- = PbSO4 Cu 6.4 g CH3OH b a 3O2 + 12e- + 12H+ = 6H2O 2CH3OH – 12e- + 2H2O =2 CO2 +12H+
【解析】(1)根据原电池中负极发生失电子的氧化反应书写。
(2)根据原电池的工作原理,负极电极反应式为Cu-2e-=Cu2+,正极电极反应式为2Fe3++2e-=2Fe2+,负极所用电极材料为Cu。根据电极反应式计算。
(3)根据图示CH3OH发生失电子的氧化反应生成CO2,b极为负极;O2发生得电子的还原反应生成H2O,a极为正极。结合原电池的工作原理作答,根据原子守恒、电荷守恒,结合酸性电解质书写电极反应式。
(1)在原电池中负极发生失电子的氧化反应,负极电极反应式为Pb-2e-+SO42-=PbSO4。
(2)根据原电池的工作原理,负极电极反应式为Cu-2e-=Cu2+,正极电极反应式为2Fe3++2e-=2Fe2+,负极所用电极材料为Cu。当线路中转移0.2mol电子时,被腐蚀Cu的物质的量为0.1mol,被腐蚀铜的质量为0.1mol![]() 64g/mol=6.4g。
64g/mol=6.4g。
(3)根据图示CH3OH发生失电子的氧化反应生成CO2,b极为负极;O2发生得电子的还原反应生成H2O,a极为正极。
①负极反应物为CH3OH,原电池中阳离子向正极迁移,H+从负极到正极,H+从b极到a极。
②正极O2发生得电子的还原反应生成H2O,1moO2得到4mol电子,正极电极反应式为3O2+12e-+12H+=6H2O;负极CH3OH发生失电子的氧化反应生成CO2,1molCH3OH失去6mol电子生成1molCO2,负极电极反应式为2CH3OH-12e-+2H2O=2CO2+12H+。


科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO为8mol.下列说法正确的是( )
A.保持其他条件不变,升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7 mol
D.CO的平衡转化率为80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应C(s)+H2O(g)H2(g)+CO(g),△H>0达到平衡后,改变某一外界条件(不改变物质的量的条件下),反应速率v与时间t的关系如图.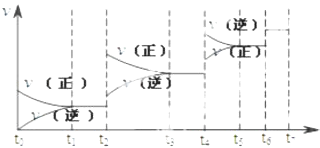
①图中t2到t3段、t4到t6段时引起平衡移动的条件分别可能是、;
②图中表示平衡混合物中CO的含量最高的一段时间是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是
A. C(s)+ CO2 ![]() 2CO反应中,增大C的量
2CO反应中,增大C的量
B. 将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C. 在H2SO4与NaOH两溶液反应时,增大压强
D. 恒温恒容条件下,在工业合成氨反应中,增加氮气的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深.Butylated Hydroxy Toluene(简称BHT)是一种常用的食品抗氧化剂,合成方法有如下两种: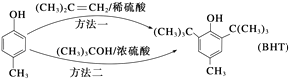
下列说法正确的是( )
A.![]() 能与Na2CO3溶液反应生成CO2
能与Na2CO3溶液反应生成CO2
B.![]() 与BHT互为同系物
与BHT互为同系物
C.BHT久置于空气中不会被氧化
D.两种方法的反应类型都是加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠是重要的防腐剂.某化学兴趣小组以碳和浓硝酸为起始原料,设计如下装置利用一氧化氮与过氧化钠反应制备亚硝酸钠.(夹持装置和A中加热装置已略,气密性已检验) 
查阅资料:①HNO2为弱酸,室温下存在反应3HNO2═HNO3+2NO↑+H2O;
②NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热。
(1)A中反应的化学方程式是_________________________________________。
(2)B中观察到的主要现象是_______________________。D装置的作用是___________________。
(3)实验经改进后可制得较纯亚硝酸钠,下列关于亚硝酸钠的说法正确的是________。
a.亚硝酸钠有咸味,可代替食盐食用
b.常温下,0.1mol/L亚硝酸溶液pH=1
c.0.1mol/L亚硝酸钠溶液中存在:c(Na+)+c(H+)=c(NO2﹣)+c(OH﹣)
d.0.1mol/L亚硝酸钠溶液中存在:c(NO2﹣)>c(Na+)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.重金属、农药和难分解的有机物等不会造成水体污染
B.“环保汽车”是指所排放的尾气污染较轻的汽车
C.煤的液化和气化过程中均要消耗一部分能量,因此将煤液化和气化后再使用,会降低煤的利用率
D.地球上的金属矿产是可以再生的资源
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com