
【题目】某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)环形玻璃搅拌棒的作用是 .
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2﹣t1)℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10﹣3kJ/(g℃),则该反应的中和热△H= .
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
【答案】
(1)使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致
(2)偏小
(3)﹣56.8 kJ/mol
(4)偏小
【解析】解:(1)中和热的测定须测量酸碱反应的热效应,使用环形玻璃搅拌棒能使溶液上下混合均匀,保证溶液上下的温度达到一致,减少实验误差,所以答案是:使酸和碱充分混合,加快反应速率,并使小烧杯内液体温度上下一致;(2)没有用水洗涤温度计上的盐酸溶液,导致盐酸的物质的量偏小,放出的热量偏小,测得的中和热数值偏小,所以答案是:偏小(3)始平均温度为t1℃,反应后最高温度为t2℃,温度差为:(t2﹣t1)℃,50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液进行中和反应生成水的物质的量为0.05L×1.0mol/L=0.005mol,溶液的质量为100g,温度变化的值为:(t2﹣t1)℃,平均值为 ![]() ℃=6.8℃,放出的热量为Q=mc△T=100g×4.18×10﹣3kJ/(g℃)×(t2﹣t1)℃,所以实验测得的中和热△H=﹣
℃=6.8℃,放出的热量为Q=mc△T=100g×4.18×10﹣3kJ/(g℃)×(t2﹣t1)℃,所以实验测得的中和热△H=﹣ ![]() =﹣56.8 kJ/mol;所以答案是:﹣56.8 kJmol﹣1 . (4)测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小;所以答案是:偏小.
=﹣56.8 kJ/mol;所以答案是:﹣56.8 kJmol﹣1 . (4)测量盐酸的温度后,温度计没有用水冲洗干净,在测碱的温度时,会发生酸和碱的中和,温度计示数变化值减小,所以导致实验测得中和热的数值偏小;所以答案是:偏小.


科目:高中化学 来源: 题型:
【题目】某无色透明的溶液中,能大量共存的离子组是( )
A. Na+、H+、SO42-、HCO3- B. Cu2+、K+、SO42-、NO3-
C. Na+、K+、Cl-、NO3- D. Ba2+、K+、SO42-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A. 已知工业合成氨的正反应方向放热,所以升温正反应速率降低,逆反应速率升高
B. 实验室用H2O2分解制备O2,加入MnO2后,反应速率明显加快
C. 2SO2+O2![]() 2SO3反应中,SO2的转化率不能达到100%
2SO3反应中,SO2的转化率不能达到100%
D. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状反应要快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
(1)Ⅰ.用高锰酸钾和浓盐酸反应制取氯气 a.该小组利用下图装置及试剂制备并收集适量Cl2 , 装置B、C的作用分别是、 . 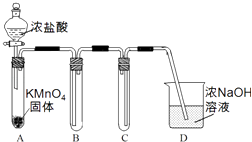
b.制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有(写出全部微粒).
c.饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HClO的方程式是 .
(2)ClO3﹣、Cl﹣和H+反应的探究 a.KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | ()mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的 .
②烧杯3取用硫酸的体积应为mL.
b.该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时pH=12的NaOH溶液100mL.,欲用以下几种方法将其pH调整到11,回答下列问题(已知混合后溶液的总体积等于混合前两稀溶液的体积之和):
(1)25℃时,pH=12的NaOH溶液中由水电离产生的c(OH﹣)=
(2)加水稀释,需加水的体积为mL.
(3)加入pH=2的盐酸,需加盐酸的体积为mL.(精确到0.1)
(4)加入pH=10的NaOH溶液,需加NaOH溶液的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂是最轻的活泼金属,其单质及其化合物有广泛的用途。回答下列问题:
(1)用碳酸锂和反应可制备氯化锂,工业上可由电解LiCl-KCl的熔融混合物生产金属锂,阴极上的电极反应式为。
(2)不可使用二氧化碳灭火器扑灭因金属锂引起的火灾,其原因是。
(3)硬脂酸锂是锂肥皂的主要成分,可作为学科&网高温润滑油和油脂的稠化剂。鉴别硬脂酸锂与硬脂酸钠、硬脂酸钾可采用的实验方法和现象分别是。
(4)LiPF6易溶于有机溶剂,常用作锂离子电池的电解质。LiPF6受热易分解,其热分解产物为PF3和。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:

(1)仪器A的名称是____________。
(2)烧瓶中发生反应的化学方程式为(含条件)________________________。
(3)为在E装置中收集到干燥纯净的氯气,装置C中盛放的试剂为_____________(填写名称),作用是____________________________。
(4)F处盛有Na2S溶液,可用置换反应的原理证明氯的非金属性强于硫。反应的离子方程式为 _________________________________________。
(5)G中加入的是淀粉碘化钾溶液,发生反应的现象为_____________________________________。
(6)H为尾气处理装置,写出该装置中的离子方程式_________________________。有人认为,用NaOH溶液吸收尾气,可能会引起倒吸。下列装置中,能起到防倒吸作用的是_______(填序号字母)。


查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能把Na2SO4、NH4NO3、KCl、(NH4)2SO4四瓶溶液区别的一种试剂是( )
A.BaCl2B.Ba(OH)2C.Ba(NO3)2D.NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,既能导电又属于电解质的一组物质是( )
A. 熔融MgCl2、熔融NaOH B. 盐酸、石灰水
C. 石墨、食醋 D. 稀硫酸、蔗糖
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com