
【题目】某兴趣小组利用文献资料设计方案对氯及其化合物进行探究.
(1)Ⅰ.用高锰酸钾和浓盐酸反应制取氯气 a.该小组利用下图装置及试剂制备并收集适量Cl2 , 装置B、C的作用分别是、 . 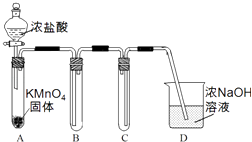
b.制得的氯气中加入适量水,得到饱和氯水,
饱和氯水中含氯元素的微粒有(写出全部微粒).
c.饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一.在过量的石灰石中加入饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去,过滤,得到的滤液其漂白性比饱和氯水更强.
①滤液漂白性增强的原因是(用化学平衡移动原理解释).
②饱和氯水与石灰石反应生成HClO的方程式是 .
(2)ClO3﹣、Cl﹣和H+反应的探究 a.KClO3、KCl与硫酸可以反应.该小组设计了系列实验研究反应条件对反应的影响,实验记录如下(实验在室温下进行):
烧杯编号 | 1 | 2 | 3 | 4 |
氯酸钾饱和溶液 | 1mL | 1mL | 1mL | 1mL |
氯化钾固体 | 1g | 1g | 1g | 1g |
水 | 8mL | 6mL | 3mL | 0mL |
硫酸(6mol/L) | 0mL | 2mL | ()mL | 8mL |
现象 | 无现象 | 溶液呈浅黄色 | 溶液呈黄绿色,生成浅黄绿色气体 | 溶液呈黄绿色, |
①该系列实验的目的 .
②烧杯3取用硫酸的体积应为mL.
b.该小组同学查资料得知:将氯酸钾固体和浓盐酸混合也能生成氯气,同时有大量ClO2生成;ClO2沸点为10℃,熔点为﹣59℃,液体为红色;Cl2沸点为﹣34℃,液态为黄绿色.设计最简单的实验验证Cl2中含有ClO2 .
【答案】
(1)收集氯气;防止D中的溶液进入B;Cl﹣、Cl2、ClO﹣、HClO;氯水中存在平衡:Cl2+H2O?HClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强;CaCO3+2Cl2+H2O═2HC1O+CO2+CaCl2
(2)5;其他条件相同时,氢离子浓度不同对化学反应速率的影响;5;收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化
【解析】解:(1)a.用高锰酸钾和浓盐酸反应制取氯气,氯气的密度比空气大,收集时采用B装置长进短出的方式,C是安全装置,防止D中的溶液进入B,所以答案是:收集氯气;防止D中的溶液进入B;b.新制的饱和氯水中存在H2O,Cl2 , HClO分子,存在H+ , OH﹣ , Cl﹣ , ClO﹣离子,含氯元素的微粒有:Cl﹣、Cl2、ClO﹣、HClO,
所以答案是:Cl﹣、Cl2、ClO﹣、HClO;c.①氯水中存在平衡:Cl2+H2OHCl+HClO,加入石灰石后,HCl与CaCO3反应浓度减小,使平衡向右移动,HClO浓度增大,漂白效果好,
所以答案是:氯水中存在平衡:Cl2+H2OHClO+HCl,CaCO3与盐酸反应使平衡正移,增大HClO的浓度,漂白效果增强;②氯水中含盐酸、次氯酸,加入石灰石后,HCl与CaCO3反应生成氯化钙、二氧化碳和水,总反应方程式为:CaCO3+2Cl2+H2O═2 HC1O+CO2+CaCl2 ,
所以答案是:CaCO3+2Cl2+H2O═2HC1O+CO2+CaCl2;(2)a.①从表中数据看出其他条件相同时,溶液的总体积相同,只有氢离子的浓度不同,得出本实验的目的为:其他条件相同时,氢离子浓度不同对化学反应速率的影响,
所以答案是:其他条件相同时,氢离子浓度不同对化学反应速率的影响;
②根据每组实验的总体积应相同计算出烧杯3取用硫酸的体积,实验1的总体积为1mL+8mL+0mL=9mL,所以烧杯3中硫酸的体积为:9mL﹣1mL﹣3mL=5mL,
所以答案是:5;b.根据ClO2沸点为10℃,熔点为﹣59℃,液体为红色,Cl2沸点为﹣34℃,液态为黄绿色,为验证Cl2中含有ClO2 , 收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化,若出现红色,则说明Cl2中含有ClO2 ,
所以答案是:收集一试管气体,盖上胶塞,放入冰水混合物中,观察液体(或气体)颜色变化.


科目:高中化学 来源: 题型:
【题目】A~J是中学化学中常见的几种物质,它们之间的转化关系如图所示.已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F化合生成,J可作杀菌消毒剂.
(1)写出B的电子式 .
(2)写出反应⑤的化学方程式: .
(3)写出反应⑦的离子方程式: .
(4)向AlCl3溶液中加入少量固体B,写出反应的化学方程式: .
(5)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则极(填“阴”或“阳”)附近溶液先由无色变为红色,请说明理由: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校为了改进碳与HNO3反应的实验,设计了如图所示的装置:先预热盛有无水CaCl2的试管I,然后投入几小块红热的炭块,再缓缓地向炭块上滴加浓HNO3 , 反应即可连续进行.
(1)由于浓HNO3易挥发,应怎样操作才能使分液漏斗中HNO3顺利滴下? .
(2)写出试管I中的化学方程式: .
(3)试管Ⅱ上方的长颈漏斗中放置一团湿棉花.其作用是 .
(4)试管Ⅱ中的现象: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,某容积固定的密闭容器中,建立下列化学平衡:C(s)+H2O(g)![]() CO(g)
CO(g)
+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是( )
A. 体系的压强不再发生变化
B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2
D. 1 mol H—H键断裂的同时断裂2 mol H—O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中,下列电离方程式书写错误的是
A.NaHCO3=Na++H++CO32-
B.Ba(OH)2=Ba2++2OH-
C.NaHSO4=Na++H++SO42-
D.BaCl2=Ba2++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有25℃时pH=12的NaOH溶液100mL.,欲用以下几种方法将其pH调整到11,回答下列问题(已知混合后溶液的总体积等于混合前两稀溶液的体积之和):
(1)25℃时,pH=12的NaOH溶液中由水电离产生的c(OH﹣)=
(2)加水稀释,需加水的体积为mL.
(3)加入pH=2的盐酸,需加盐酸的体积为mL.(精确到0.1)
(4)加入pH=10的NaOH溶液,需加NaOH溶液的体积为mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组设计用50mL1.0mol/L盐酸跟50mL1.1mol/L氢氧化钠溶液在如图装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
(1)环形玻璃搅拌棒的作用是 .
(2)中和反应放出的热量会造成少量盐酸在反应中挥发,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
(3)该实验小组做了三次实验,每次取溶液各50mL,并将实验数据记录如表:
实验序号 | 起始温度t1/℃ | 终止温度(t2)℃ | 温差(t2﹣t1)℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
1 | 25.1 | 24.9 | 25.0 | 31.8 | 6.8 |
2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
3 | 25.1 | 25.1 | 25.1 | 32.0 | 6.9 |
已知盐酸、NaOH溶液的密度与水相同,中和后生成的溶液的比热容c=4.18×10﹣3kJ/(g℃),则该反应的中和热△H= .
(4)在中和热测定实验中,测量起始温度时需要两个温度计,如果只用一个温度计测量,则测得的中和热的数值(填“偏大”、“偏小”或“不变”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学﹣﹣我们的生活,我们的未来”.下列有关知识叙述正确的是( )
A.氢气是未来的理想燃料
B.苯酚不能用于杀菌消毒
C.人体缺铁易引起甲状腺肿大
D.乙醇是不可再生的生物质能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2015·上海)将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体。原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )
A.231.5mL
B.268.8mL
C.287.5mL
D.313.6mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com