
ЁОЬтФПЁПЮЊТфЪЕЁАЮхЫЎЙВжЮЁБЃЌФГЙЄГЇФтзлКЯДІРэКЌ![]() ЗЯЫЎКЭЙЄвЕЗЯЦј(жївЊКЌN2ЁЂCO2ЁЂSO2ЁЂNOЁЂCOЃЌВЛПМТЧЦфЫћГЩЗж)ЃЌЩшМЦСЫШчЯТСїГЬЃК
ЗЯЫЎКЭЙЄвЕЗЯЦј(жївЊКЌN2ЁЂCO2ЁЂSO2ЁЂNOЁЂCOЃЌВЛПМТЧЦфЫћГЩЗж)ЃЌЩшМЦСЫШчЯТСїГЬЃК
вбжЊЃК1 mol COКЭ1 mol CH3OHЗжБ№ЭъШЋШМЩеЩњГЩCO2(g)КЭH2O(l)ЃЌЗХГіЕФШШСПЮЊ283.0kJКЭ726.5kJЁЃЯТСаЫЕЗЈДэЮѓЕФЪЧ
A.ЙЬЬх1жажївЊКЌгаCa(OH)2ЁЂCaCO3ЁЂCaSO3
B.ЦјЬхXдкСїГЬжаЬхЯжЛЙдад
C.ЯрЭЌжЪСПЕФCOКЭCH3OHЭъШЋШМЩеЃЌКѓепЗХГіЕФШШСПЖр
D.ДІРэКЌ![]() ЗЯЫЎЪБЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊЃК
ЗЯЫЎЪБЃЌЗЂЩњЗДгІЕФРызгЗНГЬЪНЮЊЃК![]() +
+![]() ЃНN2Ёќ+2H2O
ЃНN2Ёќ+2H2O
ЁОД№АИЁПB
ЁОНтЮіЁП
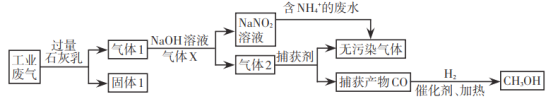
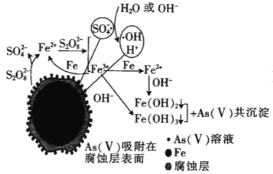
гЩСїГЬЭМПЩжЊЃЌЙЄвЕЗЯЦјжаCO2ЁЂSO2ПЩБЛЪЏЛвШщЮќЪеЃЌЩњГЩЙЬЬх1ЮЊCaCO3ЁЂCaSO3ЃЌЦјЬх1ЪЧВЛФмБЛЙ§СПЪЏЛвШщЮќЪеЕФN2ЁЂNOЁЂCOЃЌЦјЬх1ЭЈШыЦјЬхXЃЌгУЧтбѕЛЏФЦШмвКДІРэКѓЕНЕФNaNO2ЃЌXПЩЮЊПеЦјЛђбѕЦјЃЌФПЕФЪЧНЋвЛбѕЛЏЕЊбѕЛЏЮЊЖўбѕЛЏЕЊЃЌвЛбѕЛЏЕЊбѕЛЏЮЊЖўбѕЛЏЕЊгыЧтбѕЛЏФЦШмвКЗДгІЩњГЩNaNO2ЃЌNaNO2гыКЌгаNH4+ЕФШмвКЗДгІЩњГЩЮоЮлШОЦјЬхЕФЕЊЦјЃЌдђЦјЬх2КЌгаCOЁЂN2ЃЌгУВЖЛёМСВЖЛёCOЦјЬхЃЌДпЛЏМСзїгУЯТЃЌвЛбѕЛЏЬМКЭЧтЦјЙВШШЗДгІЩњГЩМзДМЁЃ
A. ЙЄвЕЗЯЦјжаCO2ЁЂSO2ПЩБЛЪЏЛвШщЮќЪеЃЌЩњГЩCaCO3ЁЂCaSO3ЃЌвђЧтбѕЛЏИЦЙ§СПЃЌдђЙЬЬх1ЮЊжївЊКЌгаCaЃЈOHЃЉ2ЁЂCaCO3ЁЂCaSO3ЃЌЙЪAе§ШЗЃЛ
B. гЩЗжЮіПЩжЊЃЌЦјЬх1жаЭЈШыЕФЦјЬхXЮЊПеЦјЛђбѕЦјЃЌФПЕФЪЧНЋвЛбѕЛЏЕЊбѕЛЏЮЊЖўбѕЛЏЕЊЃЌвЛбѕЛЏЕЊбѕЛЏЮЊЖўбѕЛЏЕЊгыЧтбѕЛЏФЦШмвКЗДгІЩњГЩNaNO2ЃЌЙЪBДэЮѓЃЛ
C. ЯрЭЌжЪСПЕФCOКЭCH3OHЭъШЋШМЩеЗХГіЕФШШСПЗжБ№ЮЊ![]() kJКЭ
kJКЭ![]() kJЃЌдђКѓепЗХГіЕФШШСПЖрЃЌЙЪCе§ШЗЃЛ
kJЃЌдђКѓепЗХГіЕФШШСПЖрЃЌЙЪCе§ШЗЃЛ
D.гЩЗжЮіПЩжЊЃЌNaNO2гыЗЯЫЎжаNH4+ЗЂЩњбѕЛЏЛЙдЗДгІЩњГЩЮоЮлШОЕФЕЊЦјКЭЫЎЃЌЗДгІЕФРызгЗНГЬЪНЮЊNH4++NO2-=N2Ёќ+2H2OЃЌЙЪDе§ШЗЃЛ
ЙЪбЁBЁЃ


 ЭЌВНСЗЯАЧПЛЏЭиеЙЯЕСаД№АИ
ЭЌВНСЗЯАЧПЛЏЭиеЙЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЃЈ1ЃЉFeCl3ЕФЫЎШмвКГЪ___________ЃЈЬюЁАЫсЁБЁЂЁАжаЁБЁЂЁАМюЁБЃЉадЃЌдвђЪЧЃЈгУРызгЗНГЬЪНБэЪОЃЉЃК____________________________________________ЃЌ
ЃЈ2ЃЉЪЕбщЪвдкХфжЦКУЕФFeCl3ШмвКжаМгЩйаэЯЁбЮЫсЕФФПЕФЪЧЃК__________________ ЁЃ
ЃЈ3ЃЉАбFeCl3ШмвКеєИЩЃЌзЦЩеЃЌзюКѓЕУЕНЕФжївЊЙЬЬхВњЮяЪЧ__________________ ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
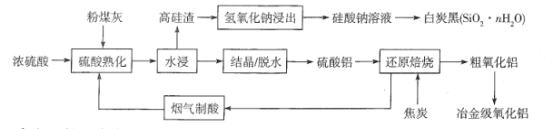
ЁОЬтФПЁПЗлУКЛвЪЧШМУКВњЩњЕФЙЄвЕЙЬЬхЗЯСЯЃЌжївЊГЩЗжгаAl2O3ЁЂSiO2 ЃЌЛЙКЌгаЩйСПFe2O3ЁЂCaOЕШЁЃВЩгУЫсМюСЊКЯЕФЗНЗЈДгЗлУКЛвжазлКЯЛиЪебѕЛЏТСМАЖўбѕЛЏЙшЕФЙЄвеСїГЬШчЯТЃК
СђЫсЪьЛЏЙ§ГЬжаЗЂЩњЕФЗДгІгаЃК
Al2O32SiO2 +3H2SO4=Al(SO4)3 +2SiO2 +3H2O
3Al2O32SiO2 +9H2SO4=3Al2( SO4)3 + 2SiO2 +9H2O
(1)ЁАНсОЇЁБВйзїЃКЛКЛКМгШШЃЌХЈЫѕжС______ ЃЌЗХжУРфШДЃЌЕУЕНAl2(SO4)318H2OЁЃ
(2)Al2(SO4)318H2Oдк250 ~300ЁцЯТЪЇжи40.5%ЕУAl2(SO4)xH2OЃЌx=______ЁЃ
(3)ЁАЛЙдБКЩеЁБЙ§ГЬжаЗЂЩњЗДгІЕФЛЏбЇЗНГЬЪНЮЊ_________ЁЃ
(4)ЩшМЦЪЕбщМьбщДжбѕЛЏТСжаЪЧЗёКЌгаFe2O3ЃК __________ЁЃ
(5)ЯђЙшЫсФЦШмвКжаЭЈШыЙ§СПCO2жЦБИАзЬПКкЕФЛЏбЇЗНГЬЪНЮЊ___________ЁЃ
(6)ДжбѕЛЏТСжЦБИвБН№МЖбѕЛЏТСЙ§ГЬжаЗЂЩњЗДгІ[ Al(OH)4]- +CO2 =Al(OH)3Ё§+ HCO3- ЃЌИУЗДгІЕФЦНКтГЃЪ§ЮЊ_______[вбжЊ Al(OH)3+H2O![]() [ Al(OH)4]-+H+ K1 =4ЁС10-13 ЃЛH2CO3
[ Al(OH)4]-+H+ K1 =4ЁС10-13 ЃЛH2CO3![]() H2O +CO2 K2 =600ЃЛ Kal(H2CO3) =4.2ЁС10-7ЁЂKa2(H2CO3) =5.6ЁС10-11]ЁЃ
H2O +CO2 K2 =600ЃЛ Kal(H2CO3) =4.2ЁС10-7ЁЂKa2(H2CO3) =5.6ЁС10-11]ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЪЕбщзАжУЛђВйзїФмДяЕНЯргІЪЕбщФПЕФ
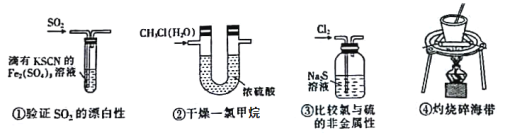
A.ЂйЂкB.ЂлЂмC.ЂкЂлD.ЂкЂм
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП2019ФъХЕБДЖћЛЏбЇНБЪкгшяЎРызгЕчГиЕФЗЂУїепЃЌLiFePO4ЪЧяЎРызгЕчГиЕФе§МЋВФСЯЁЃгУКЌяЎЗЯдќЃЈжївЊН№ЪєдЊЫиЕФКЌСПЃКLi 8.50%ЁЂNi 6.55%ЁЂMg 13.24%ЃЉжЦБИLi2C2O4ЃЌВЂгУЦфжЦБИLiFePO4ВПЗжЙЄвеСїГЬШчЭМЃЈИУСїГЬПЩФмдьГЩЫЎЬхЩщЮлШОЃЉЃК
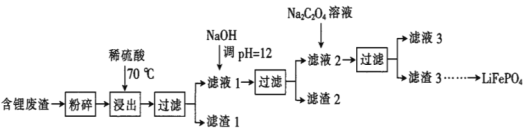
вбжЊЃКТЫвК1ЁЂТЫвК2жаВПЗжРызгЕФХЈЖШЃЈgЁЄL-1ЃЉЃК
Li+ | Ni2+ | Mg2+ | |
ТЫвК1 | 22.72 | 20.68 | 60.18 |
ТЫвК2 | 21.94 | 7.7ЁС10-3 | 0.78ЁС10-3 |
I.жЦБИLi2C2O4
(1)ТЫдќ2ЕФжївЊГЩЗжга__ЃЈЬюЛЏбЇЪНЃЉЁЃ
(2)Na2C2O4ШмвКжаИїРызгЕФХЈЖШгЩДѓЕНаЁЫГађЮЊ__ЁЃ
(3)аДГіМгШыNa2C2O4ШмвКЪБЗЂЩњЗДгІЕФРызгЗНГЬЪНЃК__ЁЃ
Ђђ.жЦБИLiFePO4
(4)НЋЕчГиМЋLi2C2O4КЭFePO4жУгкИпЮТЯТЗДгІЩњГЩLiFePO4КЭвЛжжЮТЪвЦјЬхЃЌИУЗДгІЕФЛЏбЇЗНГЬЪНЪЧ___ЁЃ
(5)LiFePO4ашвЊдкИпЮТЯТГЩаЭКѓВХФмзїЮЊЕчМЋЃЌИпЮТГЩаЭЪБвЊМгШыЩйСПЪЏФЋЃЌдђЪЏФЋЕФзїгУЪЧ__ЃЈШЮаДвЛЕуЃЉЁЃ
(6)ЮвЙњПЦбЇМвбаОПСуМлЬњЛюЛЏЙ§СђЫсФЦЃЈNa2S2O8ЃЉШЅГ§ЗЯЫЎжаЕФAs(Ђѕ)ЃЌЦфЛњжЦФЃаЭШчЭМЃЌЦфжаСуМлЬњгыЙ§СђЫсФЦЗДгІЕФРызгЗНГЬЪНЪЧ__ЁЃдкИУФЃаЭжаЕУЕНЕФЬњЩщЙВГСЕэЮяОзЦЩеЃЈЮодЊЫиЛЏКЯМлБфЛЏЃЉКѓЕУЕНвЛжжДХадЛЏКЯЮяЃЌЛЏбЇЪНЮЊFe7As2O14ЃЌИУЮяжЪжаЖўМлЬњгыШ§МлЬњЕФИіЪ§БШЮЊ__ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТБэЪЧдЊЫижмЦкБэЕФвЛВПЗжЁЃ
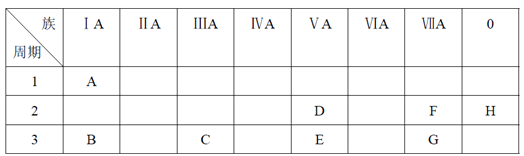
ИљОнAЁЋGдЊЫидкжмЦкБэжаЕФЮЛжУЃЌгУЛЏбЇЪНЬюаДПеАзЁЃ
ЃЈ1ЃЉбѕЛЏадзюЧПЕФЕЅжЪЪЧ______ЃЌЛЙдадзюЧПЕФЕЅжЪЪЧ______ЃЌЛЏбЇаджЪзюВЛЛюЦУЕФЕЅжЪЪЧ______ЁЃ(ЬюЯргІЕФЛЏбЇЪН)
ЃЈ2ЃЉзюЮШЖЈЕФЧтЛЏЮяЪЧ______ЁЃ(ЬюЯргІЕФЛЏбЇЪН)
ЃЈ3ЃЉвЛИіEдзгЕФКЫЭтЕчзгзмЙВга______жждЫЖЏзДЬЌЁЃ
ЃЈ4ЃЉАДМюадж№НЅМѕШѕЁЂЫсадж№НЅдіЧПЕФЫГађЃЌНЋBЁЂCЁЂEЁЂGЫФжждЊЫиЕФзюИпМлбѕЛЏЮяЖдгІЫЎЛЏЮяЕФЛЏбЇЪНХХСаГЩађЪЧ_______ЁЃ(ЬюЯргІЕФЛЏбЇЪН)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгавЛжжЛЏКЯЮяНсЙЙШчЭМЫљЪОЃЌЦфжаWЁЂXЁЂYЁЂZЮЊдзгађЪ§вРДЮдіДѓЕФЖЬжмЦкжїзхдЊЫиЃЌXЁЂYЪЧЭЌжмЦкдЊЫиЃЌZЕФКЌбѕЫсОљОпгабѕЛЏадЃЌИУЛЏКЯЮяЯрЖдЗжзгжЪСПаЁгк125ЁЃЯТСагаЙиЫЕЗЈе§ШЗЕФЪЧ
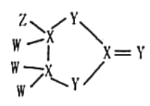
A.WZЗаЕуИпгкW2YЕФЗаЕу
B.XЕФКЌбѕЫсвЛЖЈЮЊЖўдЊШѕЫс
C.дзгАыОЖДѓаЁЃКZ>Y>X>W
D.XгыZзщГЩЕФЛЏКЯЮяжаПЩФмКЌгаЗЧМЋадМќ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПТШр(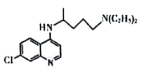 )ЖджЮСЦаТЙкВЁЖОЗЮбзгаУїШЗСЦаЇЃЌТШрЕФКЯГЩЗНЗЈШчЯТЁЃ
)ЖджЮСЦаТЙкВЁЖОЗЮбзгаУїШЗСЦаЇЃЌТШрЕФКЯГЩЗНЗЈШчЯТЁЃ
ЛиД№ЯТСаЮЪЬт
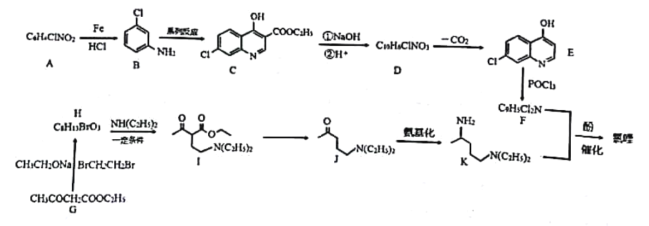
(1)AжаЫљКЌЙйФмЭХЕФУћГЦЪЧ_______________ЃЛ
(2)аДГіGЕНHЕФЗДгІРраЭ_______________ЃЛ
(3)ЬМдзгЩЯСЌга4ИіВЛЭЌЕФдзгЛђЛљЭХЪБЃЌИУЬМГЦЮЊЪжадЬМЁЃBгызуСПЧтЦјЗДгІЩњГЩЮяXЃЌаДГіXЕФНсЙЙМђЪНЃЎВЂгУаЧКХ(*)БъГіXжаЕФЪжадЬМ__________________ЃЛ
(4)аДГіCЕНDЙ§ГЬжаЂйЕФЗДгІЗНГЬЪН________________________ЃЛ
(5)аДГіОпгаШЉЛљЁЂєШЛљЁЂКЫДХЙВеёЧтЦзжЛгаЫФзщЗхЕФGЕФЭЌЗжвьЙЙЬхЫљгаЕФНсЙЙМђЪН(ВЛПМТЧСЂЬхвьЙЙ)__________________________ЁЃ
(6)ВЮПМвдЩЯКЯГЩТЗЯпЃЌЩшМЦгЩ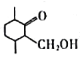 ЁЂ1вЛфхБћЭщЮЊдСЯКЯГЩ
ЁЂ1вЛфхБћЭщЮЊдСЯКЯГЩ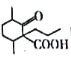 ЕФКЯГЩТЗЯп_________________________(ЮоЛњЪдМСгыКЌСНИіЬМЕФгаЛњЮяШЮбЁ)ЁЃ
ЕФКЯГЩТЗЯп_________________________(ЮоЛњЪдМСгыКЌСНИіЬМЕФгаЛњЮяШЮбЁ)ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПгУ 0.50molLЉ1NaOHБъзМвК10.00mLЃЌНЋЮДжЊХЈЖШЕФбЮЫс20.00mLЧЁКУЕЮЖЈжСжеЕуЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
A. ШєЕЮЖЈЭъБЯЃЌЕЮЖЈЙмМтзьаќгавЛЕЮвКЬхЃЌдђЫљВтЕФбЮЫсХЈЖШЦЋДѓ
B. гУСПЭВСПШЁЩЯЪібЮЫс
C. ШєбЁгУЗгЬЊзїжИЪОМСЃЌжеЕуЪБЃЌвКЬхЧЁКУЭЪЩЋ
D. бЮЫсЕФХЈЖШЮЊ1.00 molLЉ1
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com