
【题目】短周期元素Q、W、X、Y、Z在元素周期表中的对应位置如图所示,其中只有Z为金属元素。下列说法正确的是( )
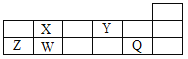
A. W、X两元素在自然界中都存在相应的单质
B. Q、Y分别与钠元素形成的化合物中仅含离子键
C. 简单离子半径由大到小的顺序为:Q>Y>Z
D. X、Z的最高价氧化物对应的水化物之间易发生化学反应
【答案】C
【解析】试题分析:由元素所在周期表中的位置可知,X为C元素,Y为O元素,Z为Al元素,W为Si元素,Q为Cl元素。A.W为Si元素,X为C元素,C在自然界中存在单质,Si为亲氧元素,在自然界中全部以化合态存在,故A错误;B.Y为O元素,Q为Cl元素,O与活泼金属形成的化合物中可以含有共价键,如过氧化钠中存在离子键和共价键,故B错误;C.电子排布相同的离子,原子序数越大,离子半径越小,电子层数越多,离子半径越大,简单离子半径由大到小的顺序为:Cl->O2->Al3+,故C正确;D.X为C元素,Z为Al元素,C的最高价氧化物的水化物为弱酸,与氢氧化铝不反应,故D错误。故选C。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水分子间存在氢键,所以水分子比较稳定
B. H2SO4溶于水能电离出H+和SO42-,所以硫酸是离子化合物
C. I2加热升华过程中只需克服分子间作用力
D. SiO2熔化破坏共价键和分子间作用力
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是 ①过滤 ②蒸发 ③溶解 ④向容量瓶转移液体
A. ①和② B. ①和③ C. ③和④ D. ①和④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】主族元素在周期表中的位置取决于( )
A.元素原子核内的中子数
B.元素的最高正化合价
C.元素原子的电子层数
D.元素原子核外的电子层数和最外层上的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将一定量的冰醋酸加水稀释,稀释过程中溶液的导电性变化如图所示。则下列说法错误的是
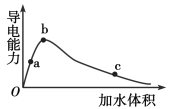
A.醋酸的电离程度:a<b<c
B.溶液的pH值:b>a>c
C.蘸取c点溶液滴在湿润的pH试纸上,测得pH值一定偏大
D.若分别向a、b、c三点的溶液中,加入同浓度的氢氧化钠溶液中和,消耗NaOH溶液的体积a=b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaH与水反应的化学方程式为NaH+H2O=NaOH+H2↑,下列有关该反应的说法正确的是
A. H2O是还原剂 B. NaH被还原
C. H2O失去电子 D. NaH发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】红矾钠(重铬酸钠:![]() )是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
)是重要的基本化工原料,应用十分广泛。工业制备红矾钠的流程如下:
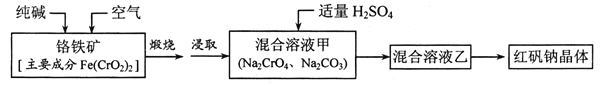
请回答下列问题:
(1)![]() 的基态电子排布式为____________。
的基态电子排布式为____________。
(2)锻烧铬铁矿发生反应:____________![]() 配平上述化学反应方程式。
配平上述化学反应方程式。
(3)溶液甲中加入H2SO4时,可以观察到溶液由黄色变为橙色,并放出无色气体,有 关反应的离子方程式为____________。
(4)制备红矾钠的废水必须进行处理。首先酸化废水,将含+6价铬的酸性废液放入电解槽内,用铁作阳极进行电解,阴极析出H2,阳极产物被![]() 氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
氧化然后转化为Cr(OH)3、 Fe(0H)3 沉淀。
①阳极的电极反应式为(不考虑后续反应):____________。
②溶液中金属离子在阴极区可沉淀完全,从水的电离平衡角度解释其原因:______。
③已知某含![]() 的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
的酸性废水中Cr元素的含量是52.5mg/L,处理后Cr元素最高允许 排量为0.5 mg/L。要处理100 m3废水达到排放标准,至少消耗铁_____kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时,CaSO4在水中的沉淀溶解平衡曲线如图所示,该条件下向100 mL的CaSO4饱和溶液中,加入200 mL 0.03 mol·L -1 的Na2SO4溶液,针对此过程的下列叙述正确的是(忽略混合过程中的体积变化)
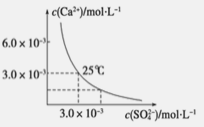
A.溶液中析出CaSO4沉淀,最终溶液中c(SO42-)较原来大
B 溶液中析出CaSO4沉淀,溶液中c(Ca2+ )、c(SO 42-)都变小
C.溶液中无沉淀析出,溶液中c(Ca2+ )、c(SO42-)都变小
D.溶液中无沉淀析出,但最终溶液中c(SO42-)较原来大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com