
分析 (1)提出猜想:三价铁离子具有氧化性,能氧化SO32-,生成硫酸根离子,同时三价铁离子被还原为亚铁离子;
(2)实验验证:
①Na2SO3具有还原性,易被氧化成硫酸钠,故要检验变质,应检验是否含硫酸根离子,取Na2SO3溶液,加入过量盐酸后,生成二氧化硫;
(3)在盐酸中能够生成与氯化钡生成的白色沉淀为硫酸钡沉淀;加入KSCN溶液,溶液变为血红色,证明溶液中存在铁离子;
(4)根①据碳酸根离子与铁离子发生了双水解生成氢氧化铁和二氧化碳写出离子方程式;②根据碳酸钠和亚硫酸钠的本身性质进行判断.
解答 解:(1)三价铁离子具有氧化性,能氧化SO32-,生成硫酸根离子,同时三价铁离子被还原为亚铁离子,其反应离子方程式为:2Fe3++SO32-+H2O=2Fe2++SO42-+2H+;
故答案为:2、1、1、2、1、2;
(2)①Na2SO3具有还原性,易被氧化成硫酸钠,故要检验变质,应检验是否含硫酸根离子,可先加过量的盐酸,使亚硫酸钠中亚硫酸根离子变成二氧化硫气体,再加氯化钡,若出现沉淀,证明有硫酸根离子,亚硫酸钠被氧化,现实验现象为无沉淀产生,说明Na2SO3没被氧化,溶液没有变质;取Na2SO3溶液,加入过量盐酸后,离子反应为:SO32-+2H+═SO2↑+H2O,
故答案为:Na2SO3溶液没有变质;SO32-+2H+═SO2↑+H2O;
(3)①实验Ⅱ:FeCl3浓溶液于试管中,逐滴加入Na2SO3浓溶液,铁离子能够与亚硫酸根离子发生水解生成了红褐色的氢氧化铁胶体;
加入KSCN溶液,溶液变为血红色,反应的离子方程式为:Fe3++3SCN-═Fe(SCN)3;
加入氯化钡生成白色沉淀,白色沉淀为硫酸钡,反应的离子方程式为:Ba2++SO42-═BaSO4↓,证明了Fe3+与SO32-发生氧化还原反应;
故答案为:Fe3+与SO32-同时发生氧化还原反应和双水解反应;
(4)①在FeCl3浓溶液中加Na2CO3浓溶液,观察到红褐色沉淀并且产生无色气体,二者发生了双水解反应,反应的离子方程式为:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑,
故答案为:2Fe3++3CO32-+3H2O═2Fe(OH)3↓+3CO2↑;
②铁离子与亚硫酸根离子生成了氢氧化铁胶体,与碳酸根离子反应生成了氢氧化铁沉淀,说明碳酸根离子水解能力比亚硫酸根离子大,
故答案为:小于.
点评 本题考查了探究反应机理的方法,题目难度中等,侧重于离子的检验的考查,充分考查了学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 充电时,阳极附近溶液的pH增大 | |
| B. | 充电时,阴极的电极反应式为pb2++2e-═pb | |
| C. | 放电时,转移1mol电子时负极减少的质量为103.5g | |
| D. | 放电时,正极的电极反应式为PbO2+2e-+4H+═pb2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
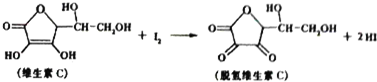
| A. | 脱氢维生素C的分子式为C6H7O6 | B. | 上述反应为氧化反应 | ||
| C. | 滴定时反应剧烈振荡锥形瓶 | D. | 滴定时不可以用淀粉溶液作指示剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4 mol•L-1 | B. | 0.6 mol•L-1 | C. | 0.9 mol•L-1 | D. | 1.2 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | A | B |
| 浓度/(mol•L-1) | 0.4 | 0.6 |
| A. | a=1.0 | |
| B. | 此时刻正反应速率小于逆反应速率 | |
| C. | 在相同条件下,若起始时加入2amolA,则达到平衡时A的转化率减小 | |
| D. | 若混合气体的平均摩尔质量不再变化,则说明反应已达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com