
【题目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下其流程图如下:
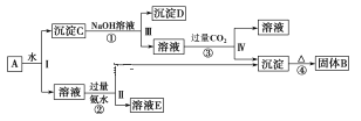
(1)写出下列B、D所含物质的化学式:固体B____; 沉淀D_____。
(2)进行操作Ⅰ、Ⅱ、Ⅲ、Ⅳ所用到的玻璃仪器为___________________;
(3)写出②、③的反应离子方程式:
②_____________________________________________。
③___________________________________________________________________
(4)KAl(SO4)2净水的原因是_____________________________。(用离子方程式和必要的文字解释)
【答案】Al2O3 Fe2O3 玻璃棒、漏斗、烧杯 Al3++3NH3·H2O = Al(OH)3↓+3NH4+ AlO2-+2H2O+CO2=Al(OH)3↓+HCO3- Al3++3H2O![]() Al(OH)3胶体+3H+,生成Al(OH)3胶体能够吸附水中的悬浮物达到净水
Al(OH)3胶体+3H+,生成Al(OH)3胶体能够吸附水中的悬浮物达到净水
【解析】
由流程图可知,由于KAl(SO4)2溶于水,Al2O3和Fe2O3均不溶于水,混合物A加水溶解后过滤,溶液中的溶质是KAl(SO4)2,沉淀C是Al2O3和Fe2O3;向沉淀C中加NaOH溶液,Fe2O3不反应,两性氧化物Al2O3可与NaOH溶液反应生成NaAlO2,则沉淀C为Fe2O3,溶液中的溶质为NaAlO2,向NaAlO2溶液中通入过量二氧化碳,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,则过滤得到沉淀为Al(OH)3,滤液为碳酸氢钠溶液;向KAl(SO4)2溶液中加过量氨水,反应生成Al(OH)3沉淀、硫酸铵和硫酸钾;将反应生成的氢氧化铝加热分解得到Al2O3,则固体B为Al2O3。
(1)由分析可知,固体B为Al2O3,沉淀D为Fe2O3,故答案为:Al2O3;Fe2O3;
(2)由流程图可知,操作Ⅰ、Ⅱ、Ⅲ、Ⅳ均为过滤,过滤所用到的玻璃仪器为玻璃棒、漏斗、烧杯,故答案为:玻璃棒、漏斗、烧杯;
(3)反应②为KAl(SO4)2溶液与过量氨水反应生成Al(OH)3沉淀、硫酸铵和硫酸钾,反应的离子方程式为Al3++3NH3·H2O = Al(OH)3↓+3NH4+;反应③为偏铝酸钠溶液与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,反应的离子方程式为,故答案为:Al3++3NH3·H2O = Al(OH)3↓+3NH4+;AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-;
(4)KAl(SO4)2净水的原因是KAl(SO4)2电离出的Al3+在溶液中水解生成Al(OH)3胶体,生成的Al(OH)3胶体具有很大的表面积,能够吸附水中的悬浮物达到净水的目的,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+,生成Al(OH)3胶体能够吸附水中的悬浮物达到净水。
Al(OH)3(胶体)+3H+,生成Al(OH)3胶体能够吸附水中的悬浮物达到净水。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】向20 mL某浓度的AlCl3溶液中滴加2 mol·L-1的NaOH溶液时,得到Al(OH)3沉淀的质量(g)与所滴加NaOH溶液的体积(mL)关系如图所示,试回答下列问题:
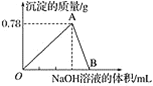
(1)图中A点表示的沉淀是__________(写化学式),其物质的量为____________。
(2)反应至A点时消耗NaOH溶液的体积为______________。
(3)图中B点溶液中的溶质有________________。
(4)AlCl3溶液的浓度为______________。
(5)O点到B点反应的总离子方程式可表示为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法正确的是
A.30g乙酸和葡萄糖混合物中的氢原子数为2NA
B.标准状况下,22.4L的H2和22.4L的F2气混合后,气体分子数为2 NA
C.常温下pH=12的NaOH溶液中,水电离出的氢离子数为10-12 NA
D.标准状况下,2.24LC2H6含有的共价键数为0.6 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1) 已知H3PO2是一元弱酸,写出H3PO2电离方程式:_________________________________,NaH2PO2是___盐(填“正盐、酸式盐或碱式盐”)。
(2)熔融NaHSO4的电离方程式:_______________________________________ ;
(3) 中国自古有“信口雌黄”“雄黄入药”之说。雌黄As2S3和雄黄As4S4都是自然界中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒疗效也用来入药。砷元素有+2、+3两种常见价态。一定条件下,雌黄和雄黄的转化关系如图所示。
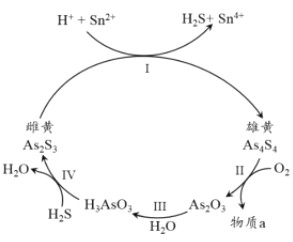
①以上转换关系图中发生的Ⅰ、Ⅱ、Ⅲ、Ⅳ反应,属于氧化还原反应的是___________.
②用双线桥法表示反应Ⅰ中的电子转移方向和数目:_________________________.
③假设物质转化率为100%,若Ⅱ中有0.1 mol As4S4反应,转移2.8 mol 电子,则标准状况下消耗O2的体积为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高氯酸铵(NH4ClO4)常作火箭发射的推进剂,实验室用NaClO4、NH4Cl等原料制取(部分物质的溶解度如图1、图2),其实验流程如图3:
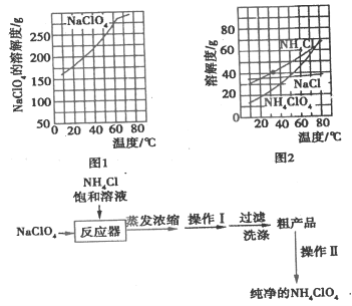
(1)反应器中发生反应的基本反应类型是________。
(2)上述流程中由粗产品获得纯净高氯酸铵的方法为________。
(3)洗涤粗产品时,宜用________(填“0℃冷水”或“80°C热水”)洗涤。
(4)已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
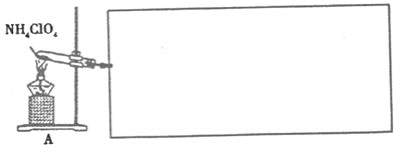
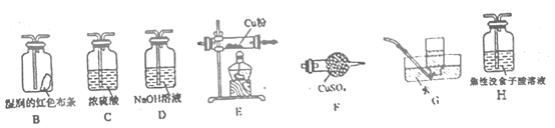
①写出高氯酸铵分解的化学方程式________。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→________(填装置对应的字母),证明氧气存在的实验现象为________。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁与稀硝酸之间的反应,某同学设计装置如下:
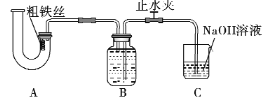
下列有关说法错误的是
A.从U型管左侧加入稀硝酸,应该打开右边的止水夹,否则硝酸无法完全浸没铁丝
B.反应结束后,在A装置中检测到了Fe2+,说明过量稀硝酸只能将铁氧化到正二价
C.B装置的作用是收集还原产物NO的,该气体不适合用排空气法收集
D.C装置吸收尾气需要O2参与反应:4NaOH +4NO +3O2 =4NaNO3 +2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2.0 L恒容密闭容器中充入1.0 mol PCl5,发生反应:PCl5(g)![]() PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
PCl3(g)+Cl2(g) ΔH=a kJ·mol-1(a>0)。0~10 min保持容器温度不变,10 min时改变一种条件,整个过程中PCl5、PCl3、Cl2的物质的量随时间的变化如图所示。
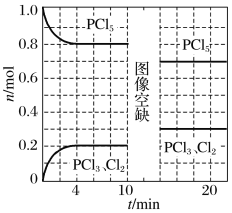
下列说法正确的是
A.0~4 min的平均速率v(PCl3)=0.025 mol·L-1·min-1
B.10 min时改变的条件是增加了一定量的PCl5
C.若起始时向该容器中充入2.0 mol PCl3和2.0 mol Cl2,保持温度为T,反应达平衡时放出的热量小于1.6a kJ
D.温度为T,起始时向该容器中充入1.0 mol PCl5、0.10 mol PCl3和0.10 mol Cl2,反应达到平衡前v正<v逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切相关.下列说法不正确的是( )
A.石油裂解可获得乙烯,可从煤干馏得到的煤焦油中提取苯
B.衣服中的棉、麻成分都属于纤维素
C.用纯碱制玻璃,用铁矿石炼铁都会产生温室气体![]()
D.地沟油和矿物油的主要化学成分相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com