
����Ŀ��ij����С�鹫˾������Li-SO2Cl2���õ�أ���ʾ��ͼ��ͼ��ʾ����֪����ܷ�ӦΪ��2Li+ SO2Cl2= 2LiCl+SO2�������������д�����ǣ� ��
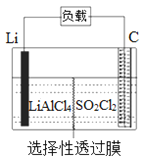
A. ��ع���ʱ����������Li������������Ӧ
B. ��ع���ʱ��������﮵缫��������������̼��
C. ��ع��������У�ʯī�缫��ӦʽΪSO2Cl2+2e-=2Cl-+SO2��
D. ��ع���ʱ�����·����0.2 mol���ӣ�����2.24 L����
���𰸡�D
��������
���ݵ�ط�Ӧʽ֪���ŵ�ʱLiԪ�ػ��ϼ���0�۱�Ϊ+1�ۣ�����Li�Ǹ�������ӦΪ��2Li-2e-�T2Li+��̼����������������SO2Cl2��+6�۵���õ��ӷ�����ԭ��Ӧ�����Ե缫��ӦʽΪ��SO2Cl2+2e-=2Cl-+SO2�������ӴӸ��������������ݴ˽��
A. �ŵ�ʱLiԪ�ػ��ϼ���0�۱�Ϊ+1�ۣ�����Li�Ǹ���������������Ӧ��A����ȷ��
B. �ŵ�ʱ��Li�Ǹ�������һ���缫��������������ʧ���ӡ������ϵõ��ӣ����Ե��ӴӸ����ص�����������������������﮵缫��������������̼����B����ȷ��
C. ��ع���ʱ��̼������������缫��ӦʽΪ��SO2Cl2+2e-=2Cl-+SO2����C����ȷ��
D. δ�����Ƿ��DZ�״������ͨ����������������������������D�����
��ѡD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������X������Y��0.16 mol����10 L�����ܱ������У�������ӦX(g)+Y(g)![]() 2Z(g)����H<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
2Z(g)����H<0��һ��ʱ���ﵽƽ�⡣��Ӧ�����вⶨ���������±���
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
����˵����ȷ����
A. ��Ӧǰ2 min��ƽ������v(Z)=2.0��10-3 mol��(L��min)-1
B. �����������䣬�����¶ȣ���Ӧ�ﵽ��ƽ��ǰv(��)>v(��)
C. ���¶��´˷�Ӧ��ƽ�ⳣ��K=1.44
D. �����������䣬�ٳ���0.2 mol Z��ƽ��ʱX�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�У�E1��134kJ��mol��1��E2��368kJ��mol��1������Ҫ��ش����⣺
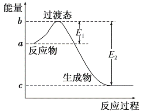
��1����ͼ��1molNO2(g)��1 molCO(g)��Ӧ����CO2��NO�����е������仯ʾ��ͼ����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ��_____��
��2���״����ӽ���Ĥȼ�ϵ���н��״�����ת��Ϊ���������ַ�Ӧ���Ȼ�ѧ����ʽ���£�
��CH3OH(g)��H2O(g)===CO2(g)��3H2(g) ��H����49.0 kJ��mol��1
��CH3OH(g)��![]() O2(g)===CO2(g)��2H2(g) ��H����192.9 kJ��mol��1
O2(g)===CO2(g)��2H2(g) ��H����192.9 kJ��mol��1
��֪��H2O(g)===H2O(l) ��H����44kJ��mol��1����״�����ȼ��ΪҺ̬ˮ���Ȼ�ѧ����ʽΪ_______��
��3����֪�ڳ��³�ѹ�£�
��2CH3OH(l)��3O2(g)===2CO2(g)��4H2O(g) ��H����1275.6 kJ��mol��1
��2CO(g)��O2(g)===2CO2(g) ��H����566.0kJ/mol
��H2O(g)===H2O(l) ��H����44.0 kJ/mol
��д��1 mol�״�����ȫȼ������1 mol һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ɳĮ������һ�����ľ۱�ϩ����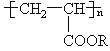 ����ˮ��Һ������һ��ʹɳĮ�������¼���������������й����⣺
����ˮ��Һ������һ��ʹɳĮ�������¼���������������й����⣺
(1)�ϳɾ۱�ϩ�����ĵ�����_____________(д�ṹ��ʽ)��
(2)����������Ӧ��ԭ����д���Ʊ���������Ļ�ѧ��Ӧ����ʽ_____________________��
(3)��ϩ�Ǻϳɾ۱�ϩ������ԭ��֮һ���������������ϩ��Ӧ����___________��
A.������Ȼ�̼��Һ B.����������Һ
C.Cu(OH)2 ����Һ D.���Ը��������Һ
д������һ����Ӧ�Ļ�ѧ����ʽ_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ײ�����ȱλ������(MFe2Ox)��3<x<4��M��ʾMn��Co��Zn��Ni�Ķ������ӣ��������£�����ʹ��ҵ�����е�SO2��NO2��������ת��Ϊ���ʡ�ת��������ͼ��ʾ�������йظ�ת�����̵�������ȷ����

A. MFe2O4�����˻�ԭ��
B. ��MFe2Ox ��H2������Ӧ�����ʵ���֮��Ϊ2��1����x=3.5
C. �ڸ÷�Ӧ��ÿ��1molNO2�ķ�����������ת�Ƶ�����4NA��
D. SO2�Ļ�ԭ�Դ���MFe2Ox
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϲ����������Ĺ���ŷ�����ȫ�����ڴ��ڹ�ʱ��Ϊ�˷�ֹ˿֯Ʒ����������Ҫ����һ���ı������壬���������ǣ� ��
A. H2 B. CO C. SO2 D. N2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɶ�����Ԫ����ɵ���ѧ�����ĺ���Ԫ�ص�����A��B��C��D,������ͼת����ϵ(����������ͷ�Ӧ��������ȥ)��

��1����AΪNa ,��EΪ________, A��ˮ��Ӧ�����ӷ���ʽΪ____________________
��2����AΪNa2O2 ,��EΪ________, A��CO2��Ӧ�Ļ�ѧ����ʽΪ____________________,ÿ��1mol Na2O2�μӷ�Ӧ��ת�Ƶ�����Ϊ________NA
��3����A������Na����Na2O2,����ת����ϵ�ж�����B��________����C��________
���͵�C��Һ��ͨ��CO2��������ɫ���壬�þ���Ϊ________���û�ѧ����ʽ��ʾ�䷴Ӧԭ��Ϊ��_____________________
����1mol/L��B��Һ��μ��뵽1L1mol/L��AlCl3��Һ�У�������ɫ����39g�����������B��Һ���������Ϊ________L����________L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йص����ʵ�˵����ȷ���ǣ� ��
A.�˹��������ܺϳɾ������������ĵ�����
B.�����ʵı����ǿ������
C.���뵰���ʺ��Ȼ��ƵĻ��Һ�ɲ��ù��˵ķ���
D.��ƽ�й����䵰������Һ���ڴ�ֱ�ڹ��ߵķ���ɿ���һ��������ͨ·
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪�����Ȼ�ѧ����ʽ��2H2��g����O2��g��===2H2O��g������H=��483��6 kJ/mol
H2��g����![]() O2��g��===H2O��g������H=��241��8 kJ/mol
O2��g��===H2O��g������H=��241��8 kJ/mol
H2��g����![]() O2��g��===H2O��l������H=��285��8 kJ/mol
O2��g��===H2O��l������H=��285��8 kJ/mol
��������ȼ����Ϊ
A. 438��6 kJ/mol B. 241��8 kJ/mol C. 285��8 kJ/mol D. ��ȷ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com