
【题目】题图中:E1=134kJ·mol-1,E2=368kJ·mol-1,根据要求回答问题:
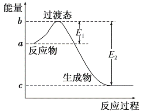
(1)如图是1molNO2(g)和1 molCO(g)反应生成CO2和NO过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:_____。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为_______。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0kJ/mol
③H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
请写出1 mol甲醇不完全燃烧生成1 mol 一氧化碳和液态水的热化学方程式:_______。
【答案】NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=-234kJ·mol-1 CH3OH(g)+![]() O2(g)===CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1 CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ/mol
O2(g)===CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1 CH3OH(l)+O2(g)===CO(g)+2H2O(l) ΔH=-442.8 kJ/mol
【解析】
(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368kJ-134kJ=234kJ;
(2)依据热化学方程式,利用盖斯定律进行计算;
(3)依据热化学方程式,利用盖斯定律进行计算。
(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量368kJ-134kJ=234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1,故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJmol-1;
(2)依据盖斯定律②×3-①×2+③×2可得CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l),则ΔH=(-192.9 kJ·mol-1)×3-(+49.0 kJ·mol-1)×2+(-44kJ·mol-1)×2=-764.7kJ·mol-1,故答案为:CH3OH(g)+
O2(g)=CO2(g)+2H2O(l),则ΔH=(-192.9 kJ·mol-1)×3-(+49.0 kJ·mol-1)×2+(-44kJ·mol-1)×2=-764.7kJ·mol-1,故答案为:CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1;
O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1;
(3)根据盖斯定律(①-②+③×4)÷2可得CH3OH(l)+O2(g)=CO(g)+2H2O(l),则△H=[-1275.6kJmol-1-(-566.0kJmol-1)+4×(-44.0kJmol-1)]÷2=-442.8 kJmol-1 ,故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=-442.8 kJmol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是
A.采用电解水法制取氢气作为新能源B.完善煤液化制取汽油的技术
C.研制推广以乙醇为燃料的汽车D.进一步提高石油加工工艺
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-![]() 2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=![]()
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
(1)连二次硝酸中氮元素的化合价为________。
(2)常温下,用0.01 mol·L-1的NaOH溶液滴定10 mL 0.01 mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。
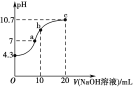
①写出H2N2O2在水溶液中的电离方程式:____________________________。
②c点时溶液中各离子浓度由大到小的顺序为_______________________________。
③b点时溶液中c(H2N2O2)________(填“>”“<”或“=”,下同)c(N2O![]() )。
)。
④a点时溶液中c(Na+)________c(HN2O)+c(N2O![]() )。
)。
(3)硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中![]() =________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=________。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关葡萄糖的说法错误的是
A.葡萄糖的分子式是C6H12O6B.葡萄糖在催化剂的作用下可水解
C.葡萄糖是人体重要的能量来源D.葡萄糖能发生银镜反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列产品或材料属于复合材料的是( )
①玻璃钢 ②采用碳纤维增强复合材料制的钓鱼竿 ③航天飞机机身 ④航天飞机隔热陶瓷瓦 ⑤纳米高分子复合材料
A. ①⑤ B. ①②③④⑤ C. ②⑤ D. ①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池总反应为:2Li+ SO2Cl2= 2LiCl+SO2↑。下列叙述中错误的是( )
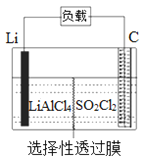
A. 电池工作时负极材料是Li,发生氧化反应
B. 电池工作时电子流向:锂电极→导线→负载→碳棒
C. 电池工作过程中,石墨电极反应式为SO2Cl2+2e-=2Cl-+SO2↑
D. 电池工作时,外电路流过0.2 mol电子,生成2.24 L气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不能用勒夏特列原理解释的是
A. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
B. H2、I2(g)混合气体加压后颜色变深
C. 红棕色的NO2加压后颜色先变深再变浅
D. 实验室用排饱和食盐水的方法收集氯气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com