
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA
B. 48g O3和O2混合气体所含原子总数为3NA
C. 在100mL18mol/L的浓硫酸中加入过量铜片并加热,生成SO2的分子数为0.9NA.
D. 标准状况下3.36LSO3中含SO3分子数目是0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。
(1)利用硫酸工业废气中的SO2 可以处理酸性含铬废水,用离子方程式表示反应原理___________。
(2)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为__________________。
(3)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的酸式电离方程式__________。
(4)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________。控制其他条件不变,反应温度对Cr3+转化率的影响如下图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:H2(g)+![]() O2(g)=H2O(g) ΔH1
O2(g)=H2O(g) ΔH1
![]() N2(g)+O2(g)=NO2(g) ΔH2
N2(g)+O2(g)=NO2(g) ΔH2
![]() N2(g)+3/2H2(g)=NH3(g) ΔH3
N2(g)+3/2H2(g)=NH3(g) ΔH3
则反应2NH3(g)+![]() O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
O2(g)=2NO2(g)+3H2O(g)的ΔH为( )
A. 2ΔH1+2ΔH2-2ΔH3B. ΔH1+ΔH2-ΔH3
C. 3ΔH1+2ΔH2+2ΔH3D. 3ΔH1+2ΔH2-2ΔH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】题图中:E1=134kJ·mol-1,E2=368kJ·mol-1,根据要求回答问题:
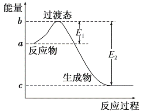
(1)如图是1molNO2(g)和1 molCO(g)反应生成CO2和NO过程中的能量变化示意图,请写出NO2和CO反应的热化学方程式:_____。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应的热化学方程式如下:
①CH3OH(g)+H2O(g)===CO2(g)+3H2(g) ΔH=+49.0 kJ·mol-1
②CH3OH(g)+![]() O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
O2(g)===CO2(g)+2H2(g) ΔH=-192.9 kJ·mol-1
又知③H2O(g)===H2O(l) ΔH=-44kJ·mol-1,则甲醇蒸气燃烧为液态水的热化学方程式为_______。
(3)已知在常温常压下:
①2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②2CO(g)+O2(g)===2CO2(g) ΔH=-566.0kJ/mol
③H2O(g)===H2O(l) ΔH=-44.0 kJ/mol
请写出1 mol甲醇不完全燃烧生成1 mol 一氧化碳和液态水的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,10 L 0.4 mol·L-1 H2O2溶液发生催化分解:2H2O2===2H2O+O2↑,不同时刻测得生成O2的体积如下表,已知反应至6 min时,H2O2分解了50%(已折算为标准状况)
t/min | 0 | 2 | 4 | 6 |
V(O2)/L | 0.0 | 9.9 | 17.2 | V=? |
下列叙述正确的是(溶液体积变化忽略不计)( )
A. 0~2 min H2O2平均反应速率比4~6 min慢
B. 反应至6 min时,共产生O2 44.8 L
C. 0~6 min的平均反应速率v(H2O2)≈3.3×10-2 mol·L-1·min-1
D. 反应至6 min时,c(H2O2)=0.3 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述正确的是

A. MFe2O4表现了还原性
B. 若MFe2Ox 与H2发生反应的物质的量之比为2∶1,则x=3.5
C. 在该反应中每有1molNO2的废气被处理将转移电子数4NA个
D. SO2的还原性大于MFe2Ox
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的是( )
选项 | 实验目的 | 实验操作 |
A | 验证NaCl溶液中混有盐酸 | 取少量溶液,滴加无色酚酞溶液 |
B | 比较Fe、Cu、Ag的金属活动性 | 铁丝浸入CuSO4溶液,铜丝浸入AgNO3溶液 |
C | 除去铁制品上的铁锈 | 将铁制品长时间浸泡在足量的稀硫酸中 |
D | 除去粗盐中的难溶性杂质 | 将粗盐研碎、溶解、蒸发 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com