
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA
B. 48g O3和O2混合气体所含原子总数为3NA
C. 在100mL18mol/L的浓硫酸中加入过量铜片并加热,生成SO2的分子数为0.9NA.
D. 标准状况下3.36LSO3中含SO3分子数目是0.15NA
科目:高中化学 来源: 题型:
【题目】已知反应A+B![]() C+D的能量变化如图所示,下列说法正确的是
C+D的能量变化如图所示,下列说法正确的是

A. 产物C的能量高于反应物的总能量
B. 若该反应中有电子得失,则可设计成原电池
C. 反应物的总能量低于生成物的总能量
D. 该反应中的反应物A和B的转化率定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理如图所示,其中NH3被氧化为常见的无毒物质。下列说法错误的是( )

A. 溶液中OH-向电极a移动
B. 电极b上发生还原反应
C. 负极的电极反应为2NH3-6e-+6OH-![]() N2+6H2O
N2+6H2O
D. 理论反应消耗的NH3与O2的物质的量之比为3:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,水只作氧化剂的是
①氟气通入水中 ②水蒸气经过灼热的焦炭 ③钠块投入水中
④铁与水蒸气反应 ⑤氯气通入水中
A. 只有①④ B. 只有①⑤
C. 只有②③ D. 只有②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了建设环境友好型社会,节能减排将成为我国政府目前工作的重点,因此节约能源与建设新能源是摆在当前的一个课题。针对这一现象,某化学学习研究性小组提出如下方案,你认为不够科学合理的是
A.采用电解水法制取氢气作为新能源B.完善煤液化制取汽油的技术
C.研制推广以乙醇为燃料的汽车D.进一步提高石油加工工艺
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述错误的是
A. 用聚光手电筒照射NaCl溶液和Fe(OH)3胶体时,产生的现象不相同
B. 胶粒能透过滤纸,但不能透过半透膜
C. 胶体与其它分散系的本身区别是丁达尔现象
D. Al(OH)3胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
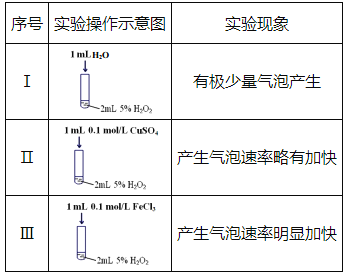
(1)实验I的作用是_________。
(2)实验III中反应的化学方程式为_________。
(3)根据实验I~III中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②___________________________。
(4)在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,6min后H2O2的浓度减小到0.10mol/L,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用50 mL 0.50 mol·L-1盐酸、50 mL 0.55 mol·L-1 NaOH溶液和下图所示装置进行测定中和热的实验,得到表中的数据:

实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | NaOH溶液 | ||
1 | 20.2 | 20.3 | 23.7 |
2 | 20.3 | 20.5 | 23.8 |
3 | 21.5 | 21.6 | 24.9 |
试完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是____________________。
不能用铜丝搅拌棒代替环形玻璃棒的理由是_____________________。
(2)经数据处理,t2—t1=3.4 ℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1 g·cm-3计算,反应后混合溶液的比热容(c)按4.18 J·(g·℃)-1计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1与ΔH的关系为:ΔH1__________ΔH(填“<”、“>”或“=”),理由是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com