
【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
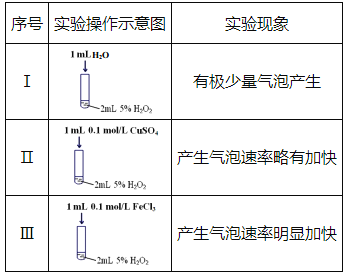
(1)实验I的作用是_________。
(2)实验III中反应的化学方程式为_________。
(3)根据实验I~III中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②___________________________。
(4)在一定温度下,10mL0.40mol/LH2O2溶液发生催化分解,6min后H2O2的浓度减小到0.10mol/L,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。
【答案】对照实验,证明实验II和III中的速率加快与溶液浓度变化无关 2H2O2![]() 2H2O+O2↑ 不同催化剂的催化效率(效果)不同 0.05 mol/(L·min)
2H2O+O2↑ 不同催化剂的催化效率(效果)不同 0.05 mol/(L·min)
【解析】
(1)实验Ⅰ中加入1mL水是让溶液总体积相同,确保双氧水的浓度相同,但没加催化剂,作对照实验;
(2)双氧水分解产生水和氧气,三氯化铁作催化剂;
(3)催化剂具有选择性;
(4)根据v=△c/△t计算得出。
(1)实验Ⅰ中加入1mL水是让溶液总体积相同,确保双氧水的浓度相同,但没加催化剂,与Ⅱ、Ⅲ相同,作对照实验,证明实验Ⅱ和Ⅲ中的速率加快与溶液浓度无关;
(2)双氧水分解产生水和氧气,三氯化铁作催化剂,反应方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
(3)根据实验现象可知Ⅱ和Ⅲ在使用不同催化剂时化学反应速率不同,说明催化剂具有选择性,即不同催化剂的催化效率不同;
(4)根据v=△c/△t=(0.40mol·L-1-0.10mol·L-1)/6min=0.05 mol/(L·min)。


科目:高中化学 来源: 题型:
【题目】关于含碳原子数相同的烯烃与烷烃(如丙烯与丙烷)的说法中,正确的是( )
A.互为同分异构体
B.属于同系物
C.都能在空气中燃烧
D.都能使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A. 常温下,5.6g铁与足量的盐酸反应,失去的电子数为0.3NA
B. 48g O3和O2混合气体所含原子总数为3NA
C. 在100mL18mol/L的浓硫酸中加入过量铜片并加热,生成SO2的分子数为0.9NA.
D. 标准状况下3.36LSO3中含SO3分子数目是0.15NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种功能高分子材料,它具有原料易得、无毒性、与血液和人体组织相容性好,不引起炎症、致癌和过敏等反应,它的最大优点是其单体在通常条件下数秒内就能聚合形成高聚物。因此这种功能高分子材料的单体A是一种迅速缝合伤口的材料,通常就是将单体A涂在手术后的伤口上进行伤口缝合。单体A是由三种化合物合成的,其结构简式如图所示:
![]() 。
。
(1)合成单体A的三种化合物是HCN、__________ 和_____________。
(2)写出A发生固化反应的化学方程式:______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质中的化学能在一定条件下可转化为电能。
(1)将锌片放入盛有稀硫酸的烧杯中,反应的离子方程式是_________。
(2)将锌片、铜片按照下图所示装置连接,能证明化学能转化为电能的实验现象是:铜片上有气泡产生、_________。
(3)稀硫酸在下图所示装置中的作用是:传导离子、_________。

(4)下列反应通过原电池装置,可实现化学能直接转化为电能的是_________ (填序号)。
①CaCO3+2HCl=CaCl2+H2O+CO2↑
②2H2+O2![]() 2H2O
2H2O
③Pb+PbO2 +2H2SO4![]() 2PbSO4+2H2O
2PbSO4+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16 mol充入10 L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A. 反应前2 min的平均速率v(Z)=2.0×10-3 mol·(L·min)-1
B. 其他条件不变,降低温度,反应达到新平衡前v(逆)>v(正)
C. 该温度下此反应的平衡常数K=1.44
D. 其他条件不变,再充入0.2 mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-,易被人体吸收积累而导致肝癌。处理工业含铬废水的方法通常是将Cr2O72-转化为Cr3+,再将Cr3+转化为Cr(OH)3沉淀。
(1)利用硫酸工业废气中的SO2 可以处理酸性含铬废水,用离子方程式表示反应原理___________。
(2)已知Ksp[Cr(OH)3]=1×10-30。室温下,除去被SO2还原所得溶液中的Cr3+[使c(Cr3+)≤1×10-6mol·L-1],需调节溶液的pH至少为__________________。
(3)Cr(OH)3和Al(OH)3类似,也是两性氢氧化物,写出Cr(OH)3的酸式电离方程式__________。
(4)Cr3+在强碱中可被双氧水氧化为CrO42-,发生反应的离子方程式为_________________。控制其他条件不变,反应温度对Cr3+转化率的影响如下图所示。请分析温度超过70℃时,Cr3+转化率下降的原因是__________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料氧缺位铁酸盐(MFe2Ox)(3<x<4;M表示Mn、Co、Zn或Ni的二价离子),常温下,它能使工业废气中的SO2、NO2等氧化物转化为单质。转化流程如图所示,下列有关该转化过程的叙述正确的是

A. MFe2O4表现了还原性
B. 若MFe2Ox 与H2发生反应的物质的量之比为2∶1,则x=3.5
C. 在该反应中每有1molNO2的废气被处理将转移电子数4NA个
D. SO2的还原性大于MFe2Ox
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com